 高中化学 1.1《化学反应与能量的变化》课件2 新人教版选修4
高中化学 1.1《化学反应与能量的变化》课件2 新人教版选修4
《高中化学 1.1《化学反应与能量的变化》课件2 新人教版选修4》由会员分享,可在线阅读,更多相关《高中化学 1.1《化学反应与能量的变化》课件2 新人教版选修4(26页珍藏版)》请在七七文库上搜索。
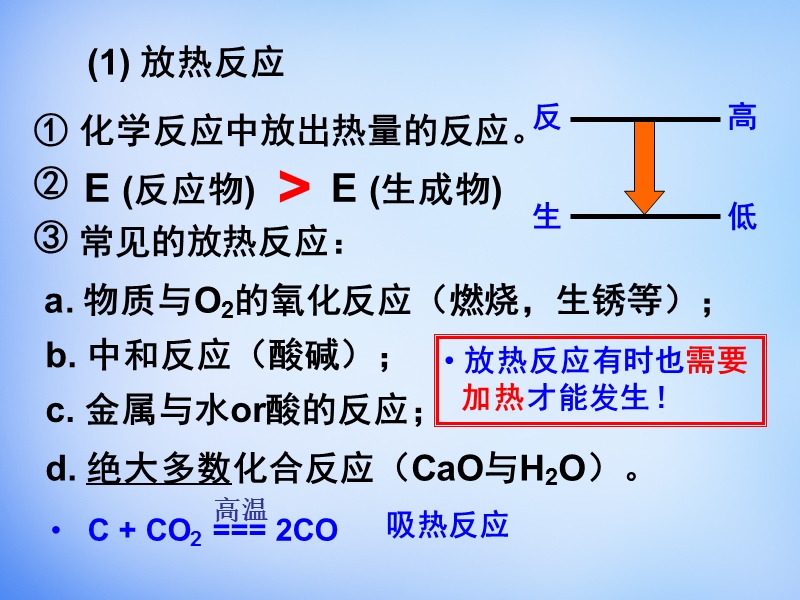
1、第一章 化学反应与能量,第一节 化学反应与能量的变化,1、化学反应的特征,物质变化,能量变化,质量守恒,能量守恒,2、化学反应中能量的变化(吸收和放出),可 以 、 、 及其它形式的能量 表现出来。,光能,热能,电能,当能量变化以热能的形式表现时,化学反应可以分为:,3、放热反应与吸热反应,反 高,生 低,生 高,反 低,放热反应,吸热反应,(熟记常见反应),反 高,(1) 放热反应, 化学反应中放出热量的反应。 ,E (反应物) E (生成物),生 低,常见的放热反应:,a. 物质与O2的氧化反应(燃烧,生锈等);,b. 中和反应(酸碱);,c. 金属与水or酸的反应;,d. 绝大多数化合反
2、应(CaO与H2O)。,C + CO2 = 2CO,吸热反应,放热反应有时也需要 加热才能发生!,高温,生 高,(2) 吸热反应, 化学反应中吸收热量的反应。 ,E (反应物) E (生成物),反 低,常见的吸热反应:,a. Ba(OH)28 H2O晶体与NH4Cl晶体反应;,b. H2与CuO等还原反应;,c. C作还原剂的反应;,d. 绝大多数分解反应。,C + CO2 = 2CO,C + H2O = CO + H2,水煤气,e. 水解反应。,一、反应热和焓变,1、反应热,化学反应中所吸收或放出的热量。,恒温恒压下,反应热称“焓变”。,2、焓变,1)符号: 2)单位:,H,kJ/mol 或
3、 kJ mol1,注:单位中的每mol是与整个反应对应的, 即反应热表示每mol反应放出或吸收的热量。,3)表示方法,放热反应 (体系能量降低):,H 0,,H为“”,吸热反应 (体系能量升高):,H 0,,H为“ + ”,所谓体系是指被研究的物质系统;而体系以外的其他部分就称为环境,4)化学反应中能量变化的原因,旧键断裂 吸收能量,新键形成 放出能量,=,=,679kJ/mol,862kJ/mol,679kJ/mol 862kJ/mol = 183kJ/mol,反应物的键能总和,生成物的键能总和,5)焓变与键能的关系(微观),H =,反应物的键能总和,生成物的键能总和,例 1:1mol C与
4、 1mol H2O(g) 反应生成 lmol CO(g) 和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为H = kJ/mol。,131.5,例 2:拆开 1mol HH键、1mol NH键、1mol NN键分别需要的能量是436kJ、391kJ、946kJ, 则1mol N2生成NH3的反应热为 , 则1mol H2生成NH3的反应热为 。,92 kJ/mol,30.67 kJ/mol,相当于 1/3 mol N2,6)焓变与物质能量的关系(宏观),H =, E 生成物, E 反应物,任何一个化学反应都包括物质的变化和能量的变化。 那么,有什么表达式能把这两种变化都表示
5、出来?,思考,只表示物质变化,【例1】 在200、101kPa时,1 mol H2与碘蒸气作用生成HI的反应,科学文献上表示为:,二、热化学方程式,能表示参加反应物质的量和反应热的 关系的化学方程式。,1、定义,2、含义,表示1mol气态H2与1mol气态碘完全反应, 生成2mol气态HI时,放出14.9kJ的热量。,3、书写要点, H2 (g) + O2(g) = H2O(g); H= 241.8 kJ/mol, H2 (g) + O2(g) = H2O(l); H= 285.8 kJ/mol, 2H2 (g) + O2(g) = 2H2O(l); H= 571.6 kJ/mol, 2H2O
6、(l) = 2H2 (g) + O2(g) ; H= + 571.6 kJ/mol, 一般应注明反应的温度、压强;,H与实验的条件、 物质的状态有关!,(250C ,101kPa时不注明), 一定标明各物质的状态(s、l、g、aq) ;,H= + 44 kJ/mol, H只放右边,以空格与标有物质状态的化学方程式隔开(数值及单位) 放热: H 0;, 系数仅仅表示物质的量,不表示分子或原子个数; 故系数可以是整数、分数、小数;,H的值与系数相匹配。,系数加倍,H值也加倍。,正逆反应的H绝对值相等,符号相反。, 反应物完全变成生成物,所释放或吸收的热量。, 热化学方程式一般不要写反应条件。,例1


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 高中化学 1.1化学反应与能量的变化课件2 新人教版选修4
- 高中化学 2.3化学平衡课件2 新人教版选修4
- 高中化学 2.1化学反应速率课件2 新人教版选修4
- 高中化学 4.1原电池课件2 新人教版选修4
- 高中化学 1.1化学反应与能量的变化课件1 新人教版选修4
- 高中化学 4.2化学电源课件2 新人教版选修4
- 高中化学 2.1化学反应速率练习 新人教版选修4
- 高中化学 2.1化学反应速率课件1 新人教版选修4
- 高中化学 1.3化学反应热的计算课件2 新人教版选修4
- 高中化学 2.4化学反应进行的方向课件1 新人教版选修4
- 高中化学 3.3盐类的水解课件2 新人教版选修4
- 第2章 化学反应与能量
- 高中化学 2.2影响化学反应速率的因素课件2 新人教版选修4
- 2-2化学反应的计算



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-98578.html