 人教版高中化学选修三 3.2.分子晶体与原子晶体第2课时(课件1)
人教版高中化学选修三 3.2.分子晶体与原子晶体第2课时(课件1)
《人教版高中化学选修三 3.2.分子晶体与原子晶体第2课时(课件1)》由会员分享,可在线阅读,更多相关《人教版高中化学选修三 3.2.分子晶体与原子晶体第2课时(课件1)(12页珍藏版)》请在七七文库上搜索。
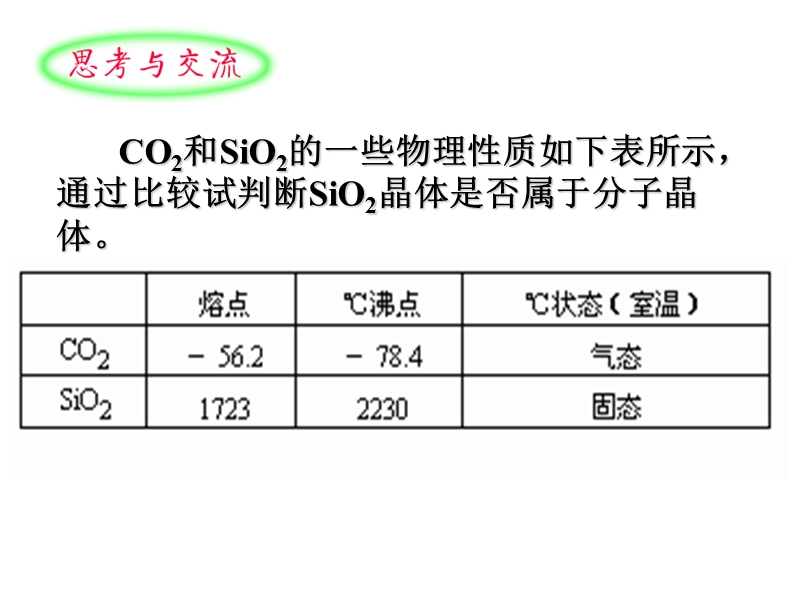
1、CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。,二、原子晶体,相邻原子间以共价键相结合而形成空间网状结构的晶体。,原子。,共价键,1、构成微粒: 2、晶体中微粒间的作用力: 3、原子晶体物理性质的共性:,熔点和沸点高,,硬度大,,一般不导电,,难溶于一些常见的溶剂。,原子晶体的熔沸点的高低的比较:,原子晶体的熔沸点取决于共价键的键长和键能, 键能越大,键长越短,共价键越强,熔沸点越高。,4、常见的原子晶体:,(1)某些非金属单质:硼(B)、硅(Si)和锗(Ge)等;,(2)某些非金属化合物:二氧化硅、碳化硅(SiC,俗称金刚砂) 氮化硼(BN)、氮化硅(
2、Si3N4),与每个C相邻有 个Si,与每个Si相邻有 个C,形成空间网状结构晶体,键角 。 虚线所示结构单元中,有 个共价键, 个C, 个Si,1molSiC形成 molSiC;,SiC的晶体结构,1、下列各组物质的晶体中,化学键类型相同, 晶体类型也相同的是 ( ) A、SO2 和 SiO2 B 、CO2 和 H2O C、NaCl 和 HCl D、CCl4 和 KCl,2、下列叙述正确的是 ( ) A.P4和NO2都是共价化合物 B.CCl4和NH3都是以极性键结合的极性分子 C.在BN和SiO2晶体中都不存在单个小分子 D.甲烷是对称平面结构,所以是非极性分子,3、判断下列说法的正误:,


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 人教版高中化学选修三 3.2 人教版 高中化学 选修
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 人教版高中化学选修三
- 高中化学
- 人教版分子和原子教案
- 如图是三个晶体物质的熔化凝固图像
- 人教版高中化学选修三 3.4 离子晶体课件2
- 人教版高中化学选修三 2.2 分子的立体结构第2课时课件2
- 人教版高中化学选修三 3.3 金属晶体课件1
- 人教版高中化学选修三 1.1原子结构第3课时课件2
- 人教版高中化学选修三 2.1 共价键第2课时课件1
- 人教版高中化学选修三 3.1 晶体的常识课件1
- 人教版高中化学选修三 3.3 金属晶体第2课时课件1
- 人教版高中化学选修三 3.4 离子晶体课件1
- 人教版高中化学选修三 1.1原子结构第2课时课件2
- 人教版高中化学选修三 2.2 分子的立体结构第1课时课件2
- 人教版高中化学选修三 1.1原子结构第1课时课件1
- 人教版高中化学选修三 2.1 共价键第1课时课件2
- 人教版高中化学选修三 3.1 晶体的常识课件2
- 人教版高中化学选修三 3.3 金属晶体第1课时课件2
- 人教版高中化学选修三 1.1原子结构第1课时课件2
- 人教版高中化学选修三 1.1原子结构第2课时课件1



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-98497.html