 人教版高中化学选修三 3.2.分子晶体与原子晶体第1课时(课件1)
人教版高中化学选修三 3.2.分子晶体与原子晶体第1课时(课件1)
《人教版高中化学选修三 3.2.分子晶体与原子晶体第1课时(课件1)》由会员分享,可在线阅读,更多相关《人教版高中化学选修三 3.2.分子晶体与原子晶体第1课时(课件1)(15页珍藏版)》请在七七文库上搜索。
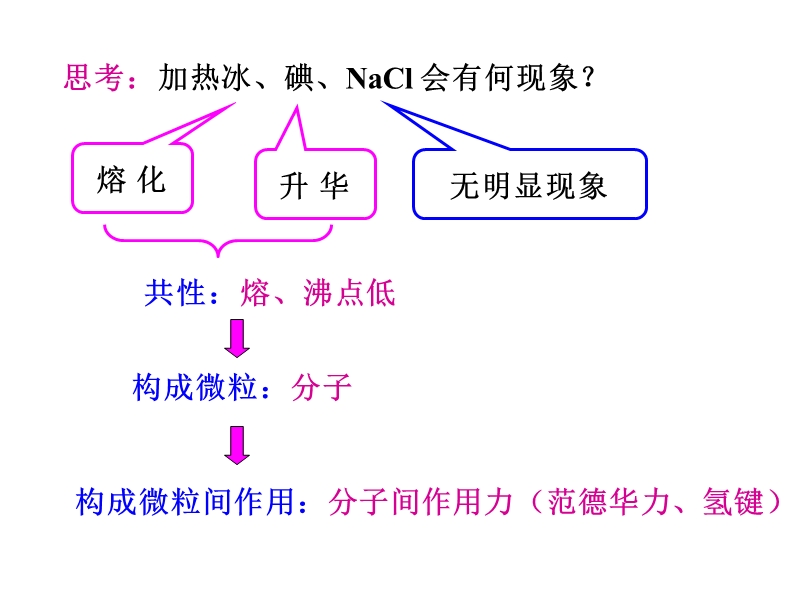
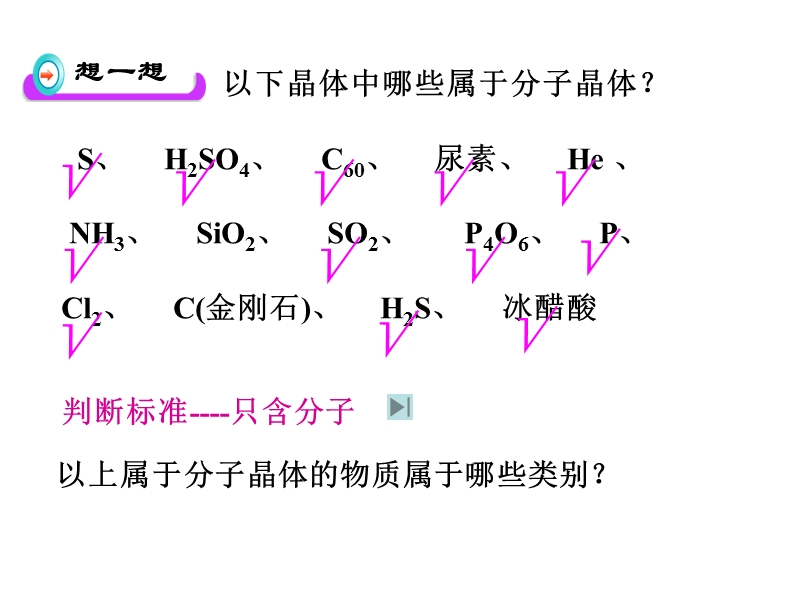
1、思考:加热冰、碘、NaCl 会有何现象?,熔 化,升 华,无明显现象,构成微粒:分子,构成微粒间作用:分子间作用力(范德华力、氢键),共性:熔、沸点低,一、分子晶体:,只含分子的晶体称为分子晶体。,1、构成微粒: 2、晶体中微粒间的作用力 分子内: 分子间: 3、分子晶体物理性质的共性:,分子,分子间作用力(范德华力、氢键),共价键,熔点低、易升华、硬度小,第二节 分子晶体与原子晶体,决定分子晶体的熔、沸点,导电性: 通常,晶体本身不导电,熔融状态也 不能导电。,以下晶体中哪些属于分子晶体? S、 H2SO4、 C60、 尿素、 He 、 NH3、 SiO2、 SO2、 P4O6、 P、 Cl
2、2、 C(金刚石)、 H2S、 冰醋酸,判断标准-只含分子,以上属于分子晶体的物质属于哪些类别?,(1)所有非金属氢化物: H2O,H2S,NH3,CH4,HX (2)部分非金属单质: X2, O2, H2, S , P, C60 (3)部分非金属氧化物: CO2, SO2, NO2, P4O6, (4)几乎所有的酸: H2SO4,HNO3,H3PO4 (5)大多数有机物的晶体: 乙醇,冰醋酸,蔗糖,4、典型的分子晶体,例外:金刚石、晶体硅等,例外:二氧化硅等,5、分子晶体的结构特征,(1)分子间只有范德华力(少数分子晶体还有氢键),分子密堆积:每个分子周围有12个紧邻的分子 如:C60、干冰

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 人教版高中化学选修三 3.2 人教版 高中化学 选修
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-98495.html