 高中化学省优质课之硫酸
高中化学省优质课之硫酸
《高中化学省优质课之硫酸》由会员分享,可在线阅读,更多相关《高中化学省优质课之硫酸(14页珍藏版)》请在七七文库上搜索。
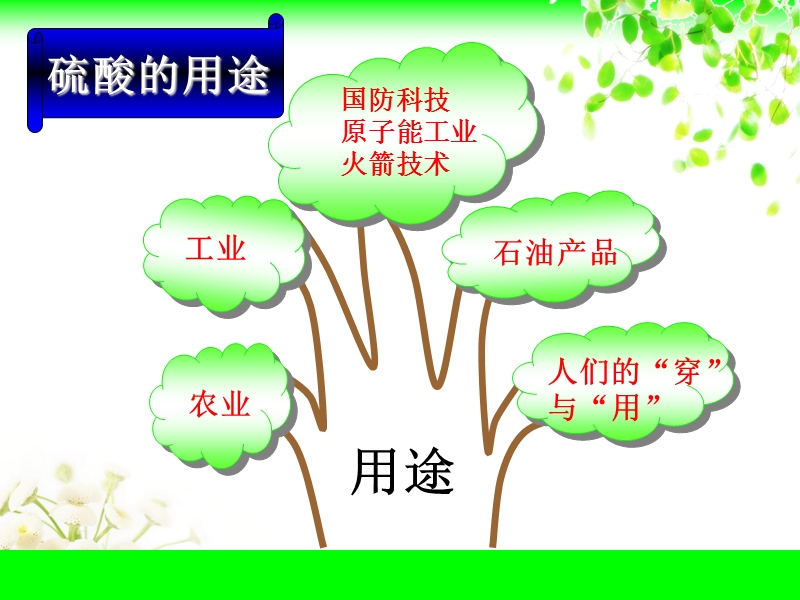
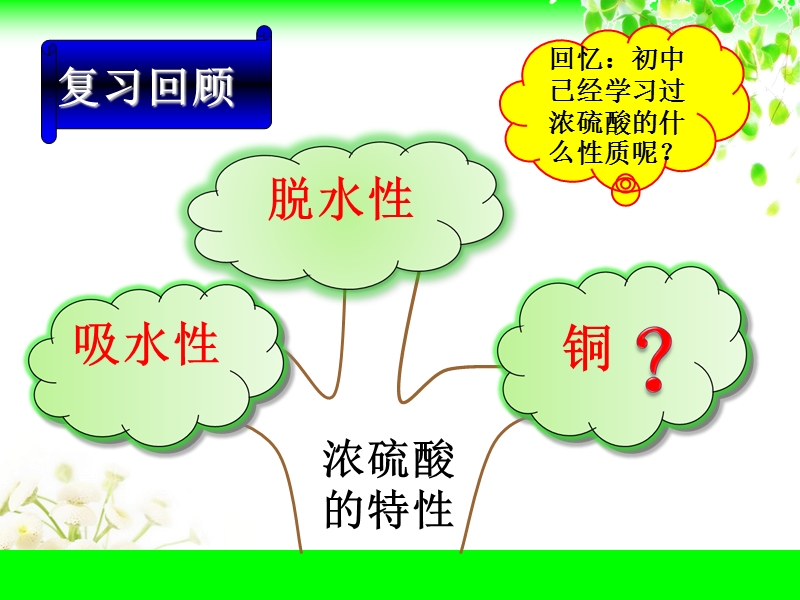
1、第二课时 硫酸,焦作一中 陈云霞,国防科技 原子能工业 火箭技术,人们的“穿”与“用”,农业,石油产品,工业,硫酸的用途,吸水性,脱水性,铜,复习回顾,回忆:初中已经学习过浓硫酸的什么性质呢?,实验4-9:探究铜与浓硫酸的反应,实验探究,你认为此实验装置有什么优缺点?,优点:抽拉的铜丝能方便的控制反应,缺点:尾气没有处理,如何针对这个缺点取长补短,对实验进行改进呢? 小组讨论:给出你们的改进方案,如何再进行改进呢?,实验改进方案1,浓硫酸,铜丝,NaOH溶液,品红溶液,用在本实验中是否是最合适的呢?,这些装置防倒吸的原理是什么呢?,你还能发现什么问题呢?,有没有其它东西也能起到防倒吸的作用呢?
2、,实验改进方案2,品红溶液,NaOH溶液,浓硫酸,铜片,现象:,根据以上现象,请写出化学方程式,并用双线桥表示,指出氧化剂、还原剂,铜片表面变黑,溶液中有灰黑色沉淀,品红溶液褪色,蓝色溶液 去哪啦?,常温下不反应,稀释后溶液呈蓝色,失2e-,得2e-,氧化性,酸性,思考在此反应过程中,浓硫酸表现出了什么性质?,从氧化还原的角度分析方程式,浓硫酸的特性:(3)强氧化性,+4,+2,0,+6,总结: 浓H2SO4 :主要由H2SO4分子构成强氧化性 (由S体现) 对应产物 SO2 稀H2SO4 :主要由H+和SO42-构成弱氧化性 (由H+体现) 对应产物 H2,思考:锌和稀硫酸反应制H2时,稀硫
3、酸做氧化剂还是还原剂?由哪种元素体现?,知识链接,生产中,用铁槽车运输浓硫酸,为什么?,2、常温下铁、铝等和浓硫酸接触时能使金属表面生成一层致密的氧化膜而阻止了反应,从而发生钝化。,用途:冷的浓硫酸可以用铁或铝制容器贮存和运输,1、在加热时,浓硫酸能与除了铂、金以外的任何其他金属反应,而且能将变价金属的单质氧化到较高的价态。,知识拓展,将足量锌粒放入浓硫酸中加热,在反应开始的一段时间内会产生H2吗?随着反应的进行呢?试解释原因?,课堂练习,今天我们学习了浓硫酸的特性,强氧化性是本节课的重点,在探究性实验中,同学们要本着绿色化学的思想,勤于思考,勇于创新,学会运用比较、归纳和概括的方法来分析问题和解决问题。,本节小结,作业布置,作业布置,(1)、分析课本上蔗糖与浓硫酸反应的实验原理,设计实验并验证产物。 (2)、浓硫酸的强氧化性能否与非金属单质及化合物反应?比如,S、 H2S、HBr、HI等?,谢谢大家,

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学 省优 硫酸
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-98098.html