 四川省泸州市泸县2020届高三上学期开学考试理综-化学试题(含答案)
四川省泸州市泸县2020届高三上学期开学考试理综-化学试题(含答案)
《四川省泸州市泸县2020届高三上学期开学考试理综-化学试题(含答案)》由会员分享,可在线阅读,更多相关《四川省泸州市泸县2020届高三上学期开学考试理综-化学试题(含答案)(9页珍藏版)》请在七七文库上搜索。
1、7.下列有关叙述正确的是A. 汽车尾气中含有的氮氧化物是汽油不完全燃烧造成的B. 酒精能使蛋白质变性,酒精纯度越高杀菌消毒效果越好C. 电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法D. 硅胶、生石灰、铁粉是食品包装中常用的干燥剂8.下式表示一种有机物的结构,关于它的性质的叙述中不正确的是A. 它有酸性,能与Na2CO3溶液反应B. 它可以水解,水解产物只有一种C. 1mol该有机物最多能和8mol NaOH反应D. 1mol该有机物最多能和8mol H2发生加成反应9.根据下列实验操作和现象所得出的结论错误的是选项操作现象结论A向蔗糖中加入浓硫酸蔗糖变成疏松多孔的海绵状碳浓硫酸具
2、有脱水性和强氧化性B向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去2min后,试管里出现凝胶非金属性:ClSiC向盛有铜片的容器中加入浓硝酸产生大量红棕色气体,溶液变为蓝绿色浓硝酸具有强氧化性和酸性D向NaAlO2溶液中持续通入气体Y出现白色沉淀Y可能是CO2气体A. A B. B C. C D. D10.设NA为阿伏加德罗常数的值,下列叙述正确的是A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等B. 1 mol Na与O2反应,生成Na2O和Na2O2的混合物共失去NA个电子C. 1mol Na2O2固体中含有离子总数为4NAD. 25时,pH=1
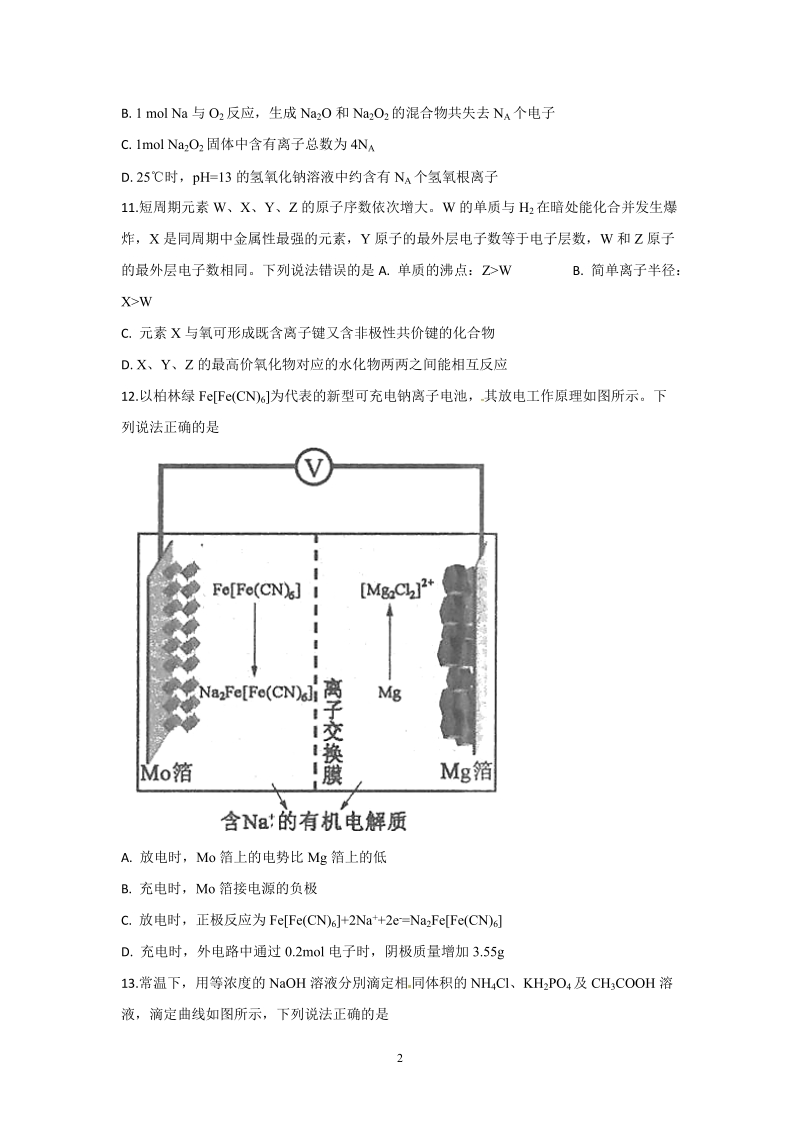
3、3的氢氧化钠溶液中约含有NA个氢氧根离子11.短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是A. 单质的沸点:ZWB. 简单离子半径:XWC. 元素X与氧可形成既含离子键又含非极性共价键的化合物D. X、Y、Z的最高价氧化物对应的水化物两两之间能相互反应12.以柏林绿FeFe(CN)6为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法正确的是A. 放电时,Mo箔上的电势比Mg箔上的低B. 充电时,Mo箔接电源的负极C. 放电时,正极反应为
4、FeFe(CN)6+2Na+2e-=Na2FeFe(CN)6D. 充电时,外电路中通过0.2mol电子时,阴极质量增加3.55g13.常温下,用等浓度的NaOH溶液分別滴定相同体积的NH4Cl、KH2PO4及CH3COOH溶液,滴定曲线如图所示,下列说法正确的是来源:学,科,网Z,X,X,KA. NH3 H2ONH4+ +OH 的 lg Kb=9.25B. CH3COOH+HPO42=CH3 COO+H2 PO4的 lg K =2.11C. 0.1mol/LKH2PO4溶液中:c(HPO42)c(H3PO4)D. 在滴定过程中,当溶液pH相同时,消耗NaOH的物质的量:CH3COOHKH2PO
5、4NH4Cl26.(14分)已知MgCl2+6NH3MgCl26NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程装置如图,放氨过程实验装置如图。己知:相关物质的性质见下表请回答:(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为_,虚框内装置的作用是_,氨化过程采用冰水浴的原因可能是_(填选项序号字母)。A 氨化过程为吸热反应,促进反应正向进行B 加快反应速率C 防止氨气从溶液中挥发,提高氨气利用率D 增大六氨氯化镁的溶解度(2)利用MgCl2溶液制备无水MgCl2,其具体操作为_。来源:Zxxk.Com(3)提纯MgCl26NH3操作中,下列
6、洗涤剂最合适的是_(填选项序号字母)。A 冰浓氨水 B 乙二醇和水的混合液C 氨气饱和的甲醇溶液 D 氨气饱和的乙二醇溶液来源:学_科_网Z_X_X_K(4)进行放氨实验时,三颈烧瓶加入1.97 g MgCl26NH3和烧碱的浓溶液,加热,并不断通入N2,通入N2目的是_。通过观察烧杯中现象的变化就可以监控MgCl26NH3的放氨过程,若要判断转化率是否达到或超过90%,则烧杯中溶液可以是_。27.(14分)某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:已知:
7、煅烧时,Cu2Te发生的反应为Cu2Te+2O22CuO+TeO2。(1)煅烧时,Cr2O3发生反应的化学方程式为_。(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有_(填化学式)。来源:学科网ZXXK(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:通过冷却结晶能析出大量K2Cr2O7的原因是_。(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 molL-1硫酸亚铁铵(NH4)2Fe(SO


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 首发 四川省 泸县 第四 中学 2020 届高三上 学期 开学 考试 化学试题
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-94691.html