 山东省2019年中考化学试题汇编海洋化学含解析
山东省2019年中考化学试题汇编海洋化学含解析
《山东省2019年中考化学试题汇编海洋化学含解析》由会员分享,可在线阅读,更多相关《山东省2019年中考化学试题汇编海洋化学含解析(7页珍藏版)》请在七七文库上搜索。
1、海洋化学22(2019泰安)化学是认识、改造和应用物质的科学。从海水中提取镁、制“碱”,都体现了人类改造物质的智慧。结合下列流程图(其中部分操作和条件已略去),请回答相关问题:(1)提纯物质常用转化的方法,就是将杂质转化为沉淀或气体而除去。粗盐中含有氯化镁、硫酸钠、氯化钙等可溶性杂质,通过步骤,再利用过滤操作进行除杂。步骤加入下列三种溶液的先后顺序为_(填字母序号);a稍过量的Na2CO3溶液 b稍过量的BaCl2溶液 c稍过量的NaOH溶液(2)母液中有MgCl2,却经历了步骤、的转化过程,其目的是_
2、;(3)步骤中先向饱和食盐水中通入氨气,有利于二氧化碳的吸收,这样做的目的是_,写出该反应的化学方程式_;(4)化学变化是改造物质的重要途径。上述流程图中没有涉及的基本反应类型是_。解析(1)粗盐水中主要含有MgCl2、Na2SO4和CaCl2等可溶性杂质,所加试剂的顺序是加稍过量的NaOH溶液,除去MgCl2,再加入稍过量的BaCl2溶液除去Na2SO4,再加稍过量的Na2CO3溶液,除去CaCl2和过量的BaCl2,顺序不唯一,只要把稍过量的BaCl2溶液放在稍过量的Na2CO3溶液前面加入就行;(2)母液中的氯化镁纯度不够高,浓度较低,经历了步骤、的转化过程,其目的是富集、提纯MgCl2
3、;(3)步骤中先向饱和食盐水中通入氨气,有利于二氧化碳的吸收,这样做的目的是促进碳酸氢钠的生成与析出;反应物是氯化钠、水、二氧化碳和氨气,生成物是氯化铵和碳酸氢钠,化学方程式为:NaCl+H2O+CO2+NH3NH4Cl+NaHCO3;(4)、和都是复分解反应;、和贝壳生成氧化钙是分解反应;氧化钙到氢氧化钙是化合反应;没有涉及的基本反应类型是置换反应。答案(1)cba(或bca或bac)(2)富集、提纯MgCl2(3)促进碳酸氢钠的生成与析出; NaCl+H2O+CO2+NH3NH4Cl+NaHCO3 (4)置换反应13.(2019威海)苦卤中提取氯化钾氯化钾是低钠盐的主要
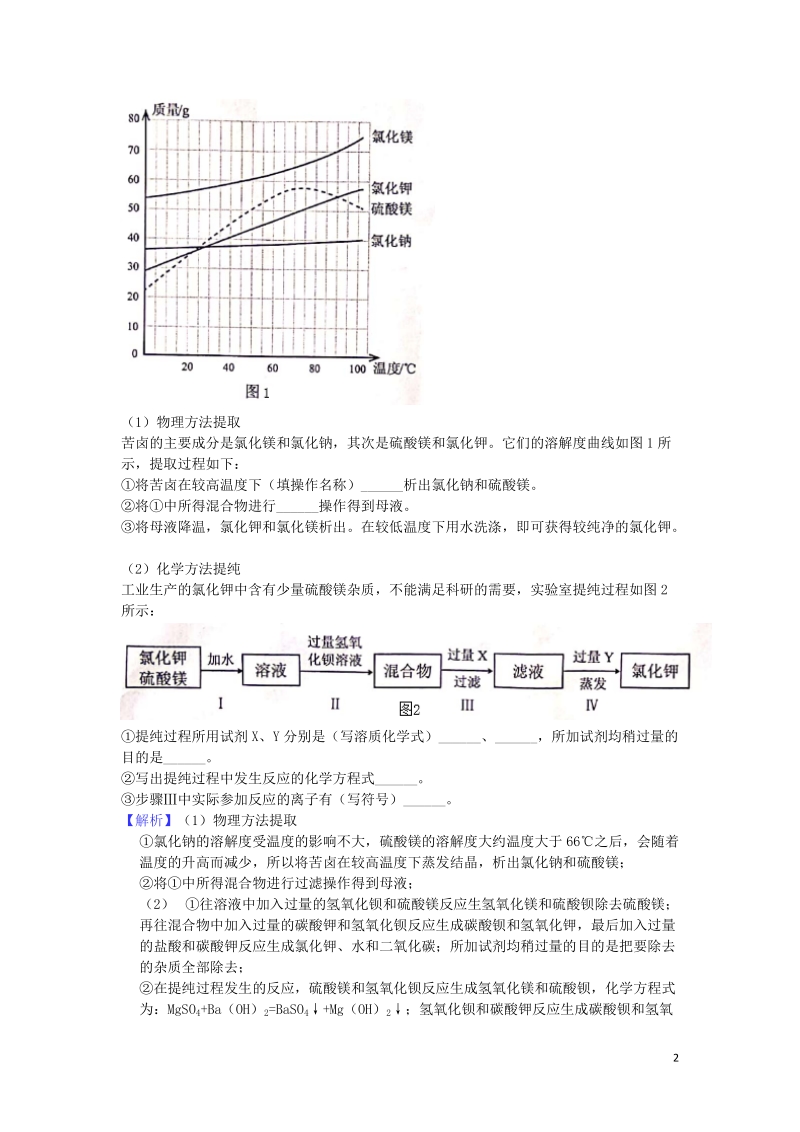
4、添加剂,从海水晒盐后的苦卤中可以提取氯化钾。(1)物理方法提取苦卤的主要成分是氯化镁和氯化钠,其次是硫酸镁和氯化钾。它们的溶解度曲线如图1所示,提取过程如下:将苦卤在较高温度下(填操作名称)_析出氯化钠和硫酸镁。将中所得混合物进行_操作得到母液。将母液降温,氯化钾和氯化镁析出。在较低温度下用水洗涤,即可获得较纯净的氯化钾。(2)化学方法提纯工业生产的氯化钾中含有少量硫酸镁杂质,不能满足科研的需要,实验室提纯过程如图2所示:提纯过程所用试剂X、Y分别是(写溶质化学式)_、_,所加试剂均稍过量的目的是_。写出提纯过程中发生反应的化学方程式_。步骤中实际参加反应的离子有(写符号)_。【解析】(1)物
5、理方法提取 氯化钠的溶解度受温度的影响不大,硫酸镁的溶解度大约温度大于66之后,会随着温度的升高而减少,所以将苦卤在较高温度下蒸发结晶,析出氯化钠和硫酸镁; 将中所得混合物进行过滤操作得到母液; (2) 往溶液中加入过量的氢氧化钡和硫酸镁反应生氢氧化镁和硫酸钡除去硫酸镁;再往混合物中加入过量的碳酸钾和氢氧化钡反应生成碳酸钡和氢氧化钾,最后加入过量的盐酸和碳酸钾反应生成氯化钾、水和二氧化碳;所加试剂均稍过量的目的是把要除去的杂质全部除去; 在提纯过程发生的反应,硫酸镁和氢氧化钡反应生成氢氧化镁和硫酸钡,化学方程式为:MgSO4+Ba(OH)2=BaSO4+Mg(OH)2;氢氧化钡和碳酸钾反应生成
6、碳酸钡和氢氧化钾,化学方程式为:Ba(OH)2+K2CO3=BaCO3+2KOH;碳酸钾和盐酸反应生成氯化钾、水和二氧化碳,化学方程式为:K2CO3+2HCl=2KCl+H2O+CO2;氢氧化钾和盐酸反应生成氯化钾和水,化学方程式为:KOH+HCl=KCl+H2O; 步骤中实际参加反应的离子有Ba2+和CO32-。 答案(1)物理方法提取 蒸发结晶过滤 (2)化学方法提纯 K2CO3 HCl 把要除去的杂质全部除去 MgSO4+Ba(OH)2=BaSO4+Mg(OH)2Ba2+和CO32-26(10分)(2019潍坊)小苏打和食盐是厨房
7、中常见物质。现有一包白色固体,可能由碳酸氢钠、氯化钠中的一种或两种物质组成。某科学小组同学展开了系列研究。(一)定性分析【实验目的】确定白色固体的组成【实验方案】:如图1所示:【实验结论】小明同学经过上述实验得出结论:该白色固体由碳酸氢钠、氯化钠两种物质组成。(1)步骤发生反应的化学方程式是NaHCO3+HClNaCl+H2O+CO2;(2)步骤中的澄清石灰水也可以用其它碱溶液代替,如氢氧化钡溶液;(3)科学小组认真研究讨论后认为,此方案不能得出小明同学的结论。一致认为将上述方案中使用的一种试剂进行调换,如仍出现上述现象,则小明同学的结论正确。调换措施是把稀盐酸改为稀硝酸。(二)定量分析【实验
8、目的】测定该白色固体中碳酸氢钠的质量分数【实验方案】该小组利用图2所示的实验装置(固定装置已略去,装置气密性良好)进行实验,每一步反应均完全进行。(1)首先称取a克该样品放入装置甲中,然后进行有关实验操作,正确的顺序是b、a、c、b、a(填序号,可重复选择)a称量装置丙的质量b打开弹簧夹,通入足量的氮气,关闭弹簧夹c打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞(2)如果没有装置乙,会造成测定结果偏大(填“偏大”“偏小”或“不变”);(3)装置丁的作用是防止空气中的二氧化碳和水蒸气进入丙装置。(三)拓展交流经査阅材料:将二氧化碳气体持续通入一定量的氢氧化钠溶液中会先后发生以下两个化学反应:2N


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 山东省 2019 年中 化学试题 汇编 海洋 化学 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 化学试题
- 山东化学中考
- 2020年广西南宁中考化学
- 贵阳中考化学
- 2019襄阳中考化学
- 柳州中考化学
- 烟台中考化学
- 2020江苏镇江中考化学
- 化学学考
- 山东省2019年中考化学试题汇编金属含解析
- 山东省2019年中考化学试题汇编工艺流程题含解析
- 山东省2019年中考化学试题汇编水含解析
- 山东省2019年中考化学试题汇编燃烧与燃料含解析
- 山东省2019年中考化学试题汇编空气与氧气含解析
- 山东省2019年中考化学试题汇编推断题含解析
- 山东省2019年中考化学试题汇编溶液含解析
- 山东省2019年中考化学试题汇编海洋化学含解析
- 山东省2019年中考化学试题汇编环境保护题含解析
- 山东省2019年中考化学试题汇编食物中的营养物质含解析
- 山东省2019年中考化学试题汇编科学探究题含解析



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-91809.html