 专题10 反应速率、化学平衡-五年高考(15-19)化学试题分类汇编(解析版)
专题10 反应速率、化学平衡-五年高考(15-19)化学试题分类汇编(解析版)
《专题10 反应速率、化学平衡-五年高考(15-19)化学试题分类汇编(解析版)》由会员分享,可在线阅读,更多相关《专题10 反应速率、化学平衡-五年高考(15-19)化学试题分类汇编(解析版)(29页珍藏版)》请在七七文库上搜索。
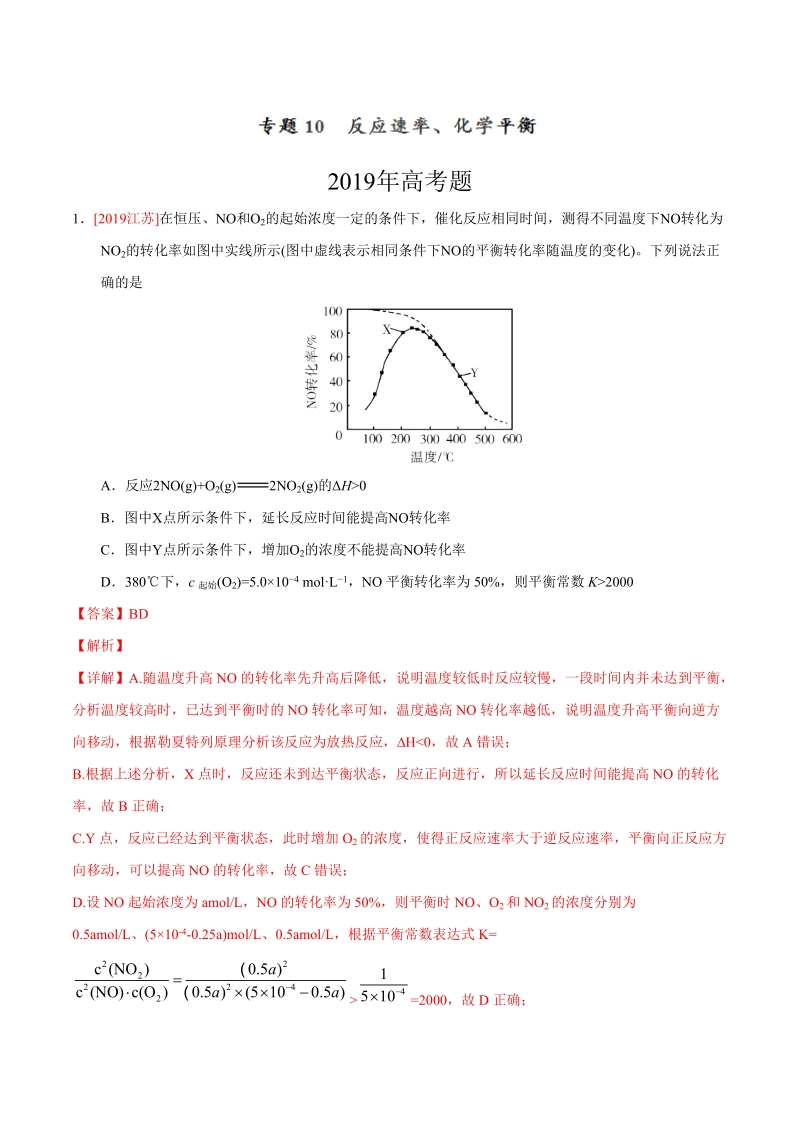
1、2019年高考题12019江苏在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是A反应2NO(g)+O2(g)2NO2(g)的H0 B图中X点所示条件下,延长反应时间能提高NO转化率C图中Y点所示条件下,增加O2的浓度不能提高NO转化率D380下,c起始(O2)=5.0104 molL1,NO平衡转化率为50%,则平衡常数K2000【答案】BD【解析】【详解】A.随温度升高NO的转化率先升高后降低,说明温度较低时反应较慢,一段时间内并未达到平衡,分析温度较高时,
2、已达到平衡时的NO转化率可知,温度越高NO转化率越低,说明温度升高平衡向逆方向移动,根据勒夏特列原理分析该反应为放热反应,H=2000,故D正确;故选BD。【点睛】解本题时需要注意:实线中在最高点之前反应没有达到平衡状态,主要讨论温度对化学反应速率的影响;最高点之后反应达到平衡状态,可以研究温度对化学平衡的影响。22019浙江选考下列说法正确的是AH(g)I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变BC(s)H2O(g) H2(g)CO(g),碳的质量不再改变说明反应已达平衡C若压强不再随时间变化能说明反应2A(?)B(g) 2C(?)已达平衡,则A、C不能同时是
3、气体D1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1【答案】B【解析】【详解】A.该可逆反应的反应前后气体计量数不发生变化,当缩小反应容器体积,相当于加压,正逆反应速率同等程度增加,A项错误;B.在建立平衡前,碳的质量不断改变,达到平衡时,质量不变,因而碳的质量不再改变说明反应已达平衡,B项正确;C.若压强不再改变说明反应达到平衡,表明反应前后气体的计量数不等,故A、C不可能均为气体,C项错误;D.易知N2(g)+3H2(g)2NH3(g) H,合
4、成氨气实际参与反应n(H2)=310=0.3mol,因而Q1=0.3/3|H|=0.1|H|,分解氨气时实际消耗的n(NH3)=210=0.2mol,Q2=0.2/2|H|=0.1|H|,则Q1=Q2,D项错误。故答案选B。32019新课标水煤气变换CO(g)+H2O(g)=CO2(g)+H2(g)是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:(1)Shibata曾做过下列实验:使纯H2缓慢地通过处于721 下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。在同一温度下用CO还原CoO(s),平衡后气
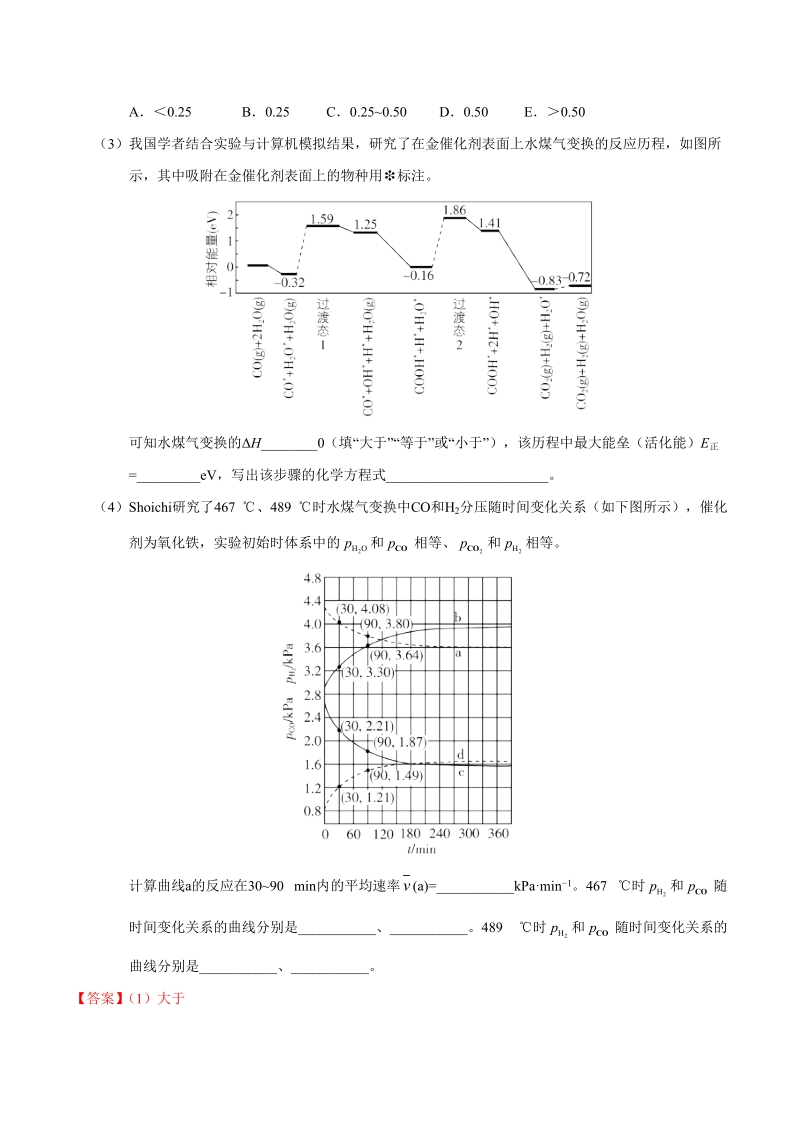
5、体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_H2(填“大于”或“小于”)。(2)721 时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_(填标号)。A0.25B0.25 C0.250.50D0.50E0.50(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。可知水煤气变换的H_0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_eV,写出该步骤的化学方程式_。(4)
6、Shoichi研究了467 、489 时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的和相等、和相等。计算曲线a的反应在3090 min内的平均速率(a)=_kPamin1。467 时和随时间变化关系的曲线分别是_、_。489 时和随时间变化关系的曲线分别是_、_。【答案】(1)大于(2)C(3)小于 2.02 COOH*+H*+H2O*COOH*+2H*+OH*(或H2O*H*+OH*)(4)0.0047 b c a d【解析】【分析】(1)由H2、CO与CoO反应后其气体物质的量分数判断二者的倾向大小;(2)根据三段式以及CO与H2的倾向大小关系
7、综合判断;(3)根据反应物与生成物的相对能量差大小进行比较判断;根据反应物达到活化状态所需能量为活化能以及相对能量差值大小计算并比较最大能垒;根据最大能垒对应的反应历程对应的物质写出方程式;(4)根据图中曲线a在3090 min内分压变化量计算平均反应速率;先根据CO与H2的倾向大小关系判断CO与H2的含量范围,然后根据温度变化对化学平衡的影响判断出在不同温度下曲线对应的物质。【详解】(1)H2还原氧化钴的方程式为:H2(g)CoO(s)Co(s)H2O(g);CO还原氧化钴的方程式为:CO(g)CoO(s)Co(s)CO2(g),平衡时H2还原体系中H2的物质的量分数()高于CO还原体系中C
8、O的物质的量分数(),故还原CoO(s)为Co(s)的倾向是CO大于H2;(2)721 时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,可设其物质的量为1mol,则CO(g)+H2O(g)CO2(g)+H2(g)起始(mol) 1 1 0 0转化(mol) x x x x平衡(mol) 1-x 1-x x x则平衡时体系中H2的物质的量分数=,因该反应为可逆反应,故x0.5,由此可判断最终平衡时体系中H2的物质的量分数介于0.250.50,故答案为C;(3)根据水煤气变换CO(g)+H2O(g)=CO2(g)+H2(g)并结合水煤气变换的反应历程相对能量可知,CO(g)+H2O(g
9、)的能量(-0.32eV)高于CO2(g)+H2(g)的能量(-0.83eV),故水煤气变换的H小于0;活化能即反应物状态达到活化状态所需能量,根据变换历程的相对能量可知,最大差值为:其最大能垒(活化能)E正=1.86-(-0.16)eV=2.02eV;该步骤的反应物为COOH+H+H2OCOOH+2H+OH;因反应前后COOH和1个H未发生改变,也可以表述成H2OH+OH;(4)由图可知,3090 min内a曲线对应物质的分压变化量p=(4.08-3.80)kPa=0.28 kPa,故曲线a的反应在3090 min内的平均速率(a)=0.0047 kPamin1;由(2)中分析得出H2的物质
10、的量分数介于0.250.5,CO的物质的量分数介于00.25,即H2的分压始终高于CO的分压,据此可将图分成两部分:由此可知,a、b表示的是H2的分压,c、d表示的是CO的分压,该反应为放热反应,故升高温度,平衡逆向移动,CO分压增加,H2分压降低,故467 时PH2和PCO随时间变化关系的曲线分别是b、c;489 时PH2和PCO随时间变化关系的曲线分别是a、d。【点睛】本题以水煤气交换为背景,考察化学反应原理的基本应用,较为注重学生学科能力的培养,难点在于材料分析和信息提取,图像比较新,提取信息能力较弱的学生,会比较吃力。第(3)问来源于我国化学工作者发表在顶级刊物Science中的文章“
11、沉积在-MoC上单层金原子对水煤气的低温催化反应”,试题以文章中的单原子催化能量变化的理论计算模型为情境,让学生认识、分析催化吸附机理及反应过程中的能量变化。本题属于连贯性综合题目,本题的解题关键在于第(1)问的信息理解与应用,若本题的第(1)问判断错误,会导致后续多数题目判断错误;第(2)问可以采取特殊值法进行赋值并结合极限法计算,考生若只是考虑到完全转化极限,则只能判断出H2的物质的量分数小于0.5,这是由于对题干的信息应用能力不熟练而导致;对于第(4)问中曲线对应物质的确定需根据第(1)(2)问得出的相关结论进行推断,需先确定物质对应曲线,然后再根据勒夏特列原理判读相关物质的变化。420
12、19新课标节选环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:(g) (g)+H2(g)H1=100.3 kJmol 1 H2(g)+ I2(g) 2HI(g)H2=11.0 kJmol 1 对于反应:(g)+ I2(g) (g)+2HI(g) H3=_kJmol 1。(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_,该反应的平衡常数Kp=_Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_(填标号)。A通入惰性气体B提高温度C增加环戊烯浓度D增加碘浓度(3)环
13、戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是_(填标号)。AT1T2Ba点的反应速率小于c点的反应速率Ca点的正反应速率大于b点的逆反应速率Db点时二聚体的浓度为0.45 molL1【答案】(1)89.3(2)403.56104BD(3)CD【解析】【分析】(1)利用盖斯定律解题;(2)利用差量法计算转化率;三行式法计算平衡常数;根据平衡移动原理解释;(3)通过外界因素对速率的影响和平衡状态的形成分析A、B、C选项,D选项观察图象计算;【详解】(1)根据盖斯定律-,可得反应的H=89.3kJ/mol;答案:89.3;(
14、2)假设反应前碘单质与环戊烯均为nmol,平衡时环戊烯反应了xmol,根据题意可知;(g)+I2(g)= (g)+2HI(g) 增加的物质的量 1mol 1mol 1mol 2mol 1molxmol 2n20%得x=0.4nmol,转化率为0.4n/n100%=40%;(g) + I2(g)= (g)+ 2HI(g)P(初) 0.5105 0.5105 0 0P 0.510540% 0.510540% 0.510540% 110540%P(平) 0.3105 0.3105 0.2105 0.4105Kp=3.56104;A.T、V一定,通入惰性气体,由于对反应物和生成物浓度无影响,速率不变,
15、平衡不移动,故A错误;B.升高温度,平衡向吸热方向移动,环戊烯转化率升高,故B正确;C增加环戊烯的浓度平衡正向移动,但环戊烯转化率降低,故C错误;D,增加I2的浓度,平衡正向移动,环戊烯转化率升高,故D正确;答案:40%;3.56104;BD;(3)A.温度越高化学反应速率越快,单位时间内反应物浓度减少越多,则T1v(逆),a点反应物浓度大于b点,故a点正反应速率大于b点,故C正确;D.b点时环戊二烯浓度由1.5mol/L减小到0.6mol/L,减少了0.9mol/L,因此生成二聚体0.45mol/L,故D正确;答案:CD。52019新课标节选近年来,随着聚酯工业的快速发展,氯气的需求量和氯化
16、氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) c(O2)分别等于11、41、71时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300)_K(400)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)c(O2)=11的数据计算K(400)=_(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)c(O2)过低、过高的不利影响分别是_
17、。(2)Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+Cl2(g) H1=83 kJmol-1CuCl(s)+O2(g)=CuO(s)+Cl2(g) H2=-20 kJmol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) H3=-121 kJmol-1则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的H=_ kJmol-1。(3)在一定温度的条件下,进一步提高HCl的转化率的方法是_。(写出2种)【答案】(1)大于 O2和Cl2分离能耗较高、HCl转化率较低(2)116(3)增加反应体系压强、及时除去产物【解析】【详解】(1)根据反
18、应方程式知,HCl平衡转化率越大,平衡常数K越大,结合图像知升高温度平衡转化率降低,说明升高温度平衡向逆反应方向进行,则K(300)K(400);由图像知,400时,HCl平衡转化率为84%,用三段式法对数据进行处理得:起始(浓度) c0 c0 0 0变化(浓度) 0.84c0 0.21c0 0.42c0 0.42c0平衡(浓度)(1-0.84)c0 (1-0.21)c0 0.42c0 0.42c0则K=;根据题干信息知,进料浓度比过低,氧气大量剩余,导致分离产物氯气和氧气的能耗较高;进料浓度比过高,HCl不能充分反应,导致HCl转化率较低;(2)根据盖斯定律知,(反应I+反应II+反应III

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 专题10 反应速率、化学平衡-五年高考15-19化学试题分类汇编解析版 专题 10 反应 速率 化学平衡 年高 15 19 化学试题 分类 汇编 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 专题03
- 化学平衡
- 化学试题
- 氧化还原反应-五年高考15-19化学试题分类汇编解析版
- 工艺流程题-五年高考15-19化学试题分类汇编解析版
- 平衡原理综合应用-五年高考15-19化学试题分类汇编解析版
- 离子反应-五年高考15-19化学试题分类汇编解析版
- 反应速率化学平衡-五年高考15-19化学试题分类汇编原卷版
- 专题04 离子反应-五年高考15-19化学试题分类汇编解析版
- 反应速率化学平衡-五年高考15-19化学试题分类汇编解析版
- 化学与技术选修-五年高考15-19化学试题分类汇编解析版
- 离子反应-五年高考15-19化学试题分类汇编原卷版
- 化学计量与化学计算-五年高考15-19化学试题分类汇编解析版
- 化学与STSE-五年高考15-19化学试题分类汇编解析版
- 有机化学基础-五年高考15-19化学试题分类汇编解析版
- 氧化还原反应-五年高考15-19化学试题分类汇编原卷版
- 反应平衡



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-91209.html