 2019年湖北省荆州市中考化学试卷含详细答案
2019年湖北省荆州市中考化学试卷含详细答案
《2019年湖北省荆州市中考化学试卷含详细答案》由会员分享,可在线阅读,更多相关《2019年湖北省荆州市中考化学试卷含详细答案(22页珍藏版)》请在七七文库上搜索。
1、第 1 页(共 22 页)2019 年湖北省荆州市中考化学试卷一、选择题1 (2 分)诗词是中华民族的文化瑰宝,下列诗句中隐含有化学变化的是( )A千锤万凿出深山B蜡炬成灰泪始干C只要功夫深,铁杵磨成针D夜来风雨声,花落知多少2 (2 分) “绿水青山就是金山银山” 。下列倡议不符合该理念的是( )A秸杆就地焚烧B合理施用化肥和农药C回收并集中处理废旧电池D用清洁能源替代化石燃料3 (2 分)下列物质不是氧化物的是( )A冰 B干冰 C臭氧 D过氧化氢4 (2 分)下列关于分子的说法不正确的是( )A分子在不断运动B分子之间有间隔C分子构成所有的物质D水分子保持水的化学性质5 (2 分)下列有
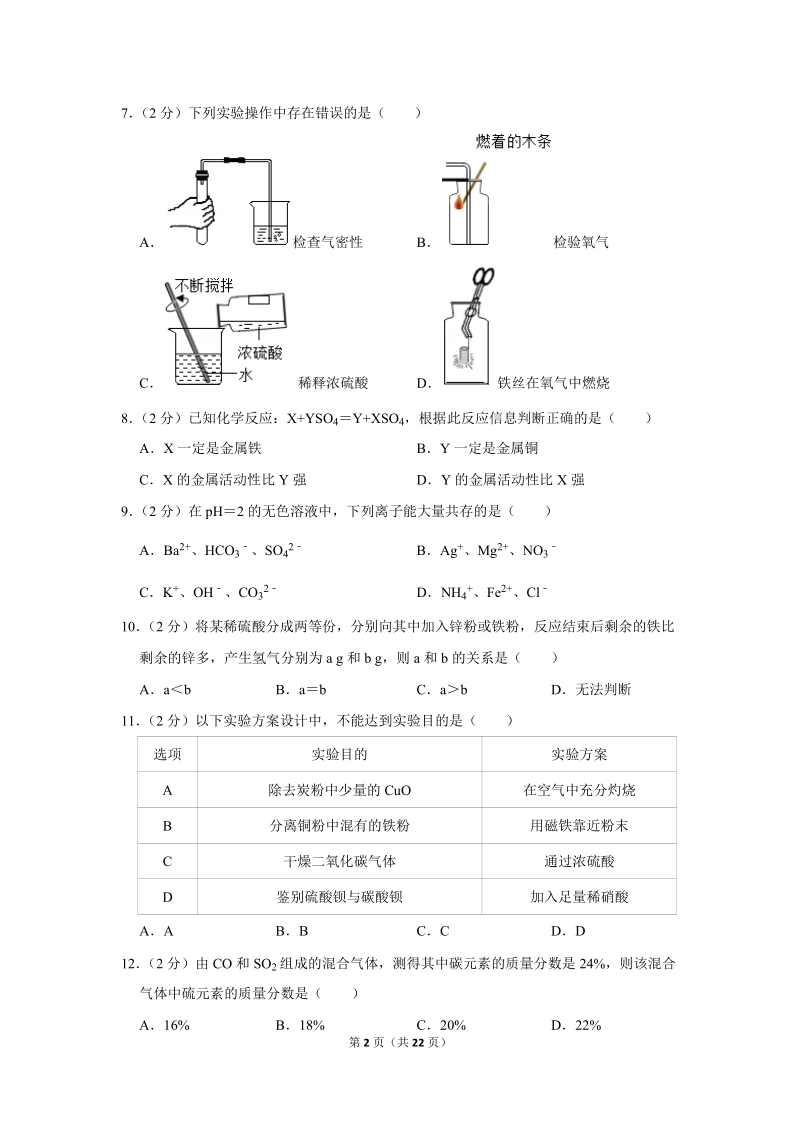
2、关催化剂的说法正确的是( )A只能加快反应速率B二氧化锰在任何化学反应中都是催化剂C能增加生成物的质量D质量和化学性质在化学反应前后不变6 (2 分)下列灭火原理与“釜底抽薪”相同的是( )A锅内油着火用锅盖盖灭B用高压水枪喷水灭火C砍掉部分林木形成隔离带灭火D用二氧化碳灭火器灭火第 2 页(共 22 页)7 (2 分)下列实验操作中存在错误的是( )A 检查气密性 B 检验氧气C 稀释浓硫酸 D 铁丝在氧气中燃烧8 (2 分)已知化学反应:X+YSO 4Y+XSO 4,根据此反应信息判断正确的是( )AX 一定是金属铁 BY 一定是金属铜CX 的金属活动性比 Y 强 DY 的金属活动性比 X
3、 强9 (2 分)在 pH2 的无色溶液中,下列离子能大量共存的是( )ABa 2+、HCO 3 、SO 42 BAg +、Mg 2+、NO 3CK +、OH 、CO 32 DNH 4+、Fe 2+、Cl 10 (2 分)将某稀硫酸分成两等份,分别向其中加入锌粉或铁粉,反应结束后剩余的铁比剩余的锌多,产生氢气分别为 a g 和 b g,则 a 和 b 的关系是( )Aab Bab Cab D无法判断11 (2 分)以下实验方案设计中,不能达到实验目的是( )选项 实验目的 实验方案A 除去炭粉中少量的 CuO 在空气中充分灼烧B 分离铜粉中混有的铁粉 用磁铁靠近粉末C 干燥二氧化碳气体 通过浓
4、硫酸D 鉴别硫酸钡与碳酸钡 加入足量稀硝酸AA BB CC DD12 (2 分)由 CO 和 SO2 组成的混合气体,测得其中碳元素的质量分数是 24%,则该混合气体中硫元素的质量分数是( )A16% B18% C20% D22%第 3 页(共 22 页)二、填空题(20 分)13 (4 分)化学与生活密切相关。请回答下列问题:(1)荆州是鱼米之乡,大米中含有的主要糖类物质是 (填名称) 。(2)亚硝酸钠(NaNO 2)有毒,其中氮元素的化合价为 。(3)煤炉火焰越扇越旺,是因为扇风时提供了更多的 。(4)羊毛、棉花、腈纶中属于合成纤维的是 。14 (4 分)用化学式或化学方程式表示:(1)生
5、理盐水中的溶质是 。(2)稀盐酸、稀硫酸的一些化学性质相似,是因为它们的溶液中都含有 。(3)驱动氢能汽车的能量可来源于氢气燃烧,其反应的化学方程式为 。(4)实现“险在荆江”到“美在荆江” ,农林工作者用波尔多液Ca(OH) 2 与 CuSO4的混合物给沿岸树木杀菌,两者反应的化学方程式为 。15 (4 分)硒(Se)是一种多功能生命营养素,其原子结构示意图如图所示。请回答下列问题:(1)图中 x 。(2)硒元素与硫元素在元素周期表中处在同一个 (填“横行”或“纵行” ) ,两者化学性质相似的原因是 。(3)硒酸与氢氧化钾溶液完全反应的化学方程式为 。16 (4 分)甲、乙、丙三种物质的溶解
6、度曲线如图所示。请回答下列问题:(1)在 060之间,三种物质中溶解度受温度影响最小的是 。(2)20时,三种物质的溶解度由小到大的顺序为 。(3)在不改变溶液中溶质的质量分数的前提下,要使接近饱和的丙溶液变为饱和溶液,可采取的一种措施是 。(4)50时,将甲、乙、丙各 20 g 分别加入盛有 50 g 水的烧杯中,充分溶解,静置,然后各取上层清液 m g,再降温至 10,此时三种溶液中溶质的质量分数分别为 (甲)第 4 页(共 22 页)、(乙) 、 (丙) ,则三者之间的大小关系是 。17 (4 分)A、B、C、D 都是九年级化学教材中较常见的物质,它们存在如图所示的转化关系(反应条件略去
7、) 。(1)若 A 为较活泼金属,C 为气体单质,则该反应的基本反应类型是 。(2)分别写出一个符合下列要求的化学方程式。若 C 为金属单质,A、B、D 都是化合物: 。若 A 是最简单的有机物,C 为水: 。(3)若 A 为蓝色溶液,生成的 C、D 都是沉淀,则 B 可能是 。三、实验题(10 分)18 (4 分)根据如图回答问题:(1)酒精灯加热时,应用温度最高的 焰。(2)实验室制取二氧化碳时,选择的发生装置和收集装置依次是 (填字母) ,该反应的化学方程式是 。(3)实验室用装置 A 作为制取氧气的发生装置,反应结束后,若要分离出 MnO2,除第 5 页(共 22 页)AF 中相关仪器
8、外,还需补充的一种玻璃仪器是 (写名称) 。19 (6 分)现有一瓶无色溶液,溶质可能是 KOH、K 2CO3 中的一种或两种,某兴趣小组对其成分进行如下实验探究:【查阅资料】KOH 与 NaOH 的化学性质相似,K 2CO3 与 Na2CO3 的化学性质相似。K2CO3 溶液呈碱性,BaCl 2 溶液、CaCl 2 溶液、KCl 溶液呈中性。【实验探究】设计并进行实验实验操作步骤 实验现象 实验结论(1)向盛有少量样品溶液的试管中加入过量 CaCl2 溶液 肯定含有K2CO3(2)将操作(1)后的试管静置,再向上层清液中加入几滴酚酞溶液酚酞溶液变红色肯定含有 【评价反思】甲同学提出操作(1)
9、加入的 CaCl2 溶液必须过量,其目的是证明K2CO3 存在的同时还要 。乙同学提出操作(1)在溶液较浓时,没有 K2CO3 也能产生相同现象,其原因是 ;建议改加过量的 BaCl2 溶液,BaCl 2 参加反应的化学方程式为 。【拓展应用】KOH 和 K2CO3 的混合溶液敞口久置后可能变成 K2CO3 溶液,反应的化学方程式为 。四、计算题(6 分)20 (6 分)向盛有 Fe2O3 粉末的烧杯中加入过量的稀 H2SO4,充分搅拌,粉末完全溶解;再向所得溶液中逐滴加入 NaOH 溶液,生成沉淀与加入 NaOH 溶液之间的质量关系如图所示。请回答下列问题:(1)写出 AB 段内反应的化学方
10、程式: 。(2)加入 NaOH 溶液 40 g 时溶液中存在的溶质是 (写化学式) 。(3)计算氢氧化钠溶液中溶质的质量分数。 (要求写出计算过程)第 6 页(共 22 页)第 7 页(共 22 页)2019 年湖北省荆州市中考化学试卷参考答案与试题解析一、选择题1 (2 分)诗词是中华民族的文化瑰宝,下列诗句中隐含有化学变化的是( )A千锤万凿出深山B蜡炬成灰泪始干C只要功夫深,铁杵磨成针D夜来风雨声,花落知多少【分析】本题考查学生对物理变化和化学变化的确定。判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化。【解
11、答】解:A、千锤万凿出深山,只是将石头开采出来,没有新物质生成,属于物理变化,故 A 错;B、蜡炬成灰泪始干,包含着物质蜡烛燃烧生成二氧化碳和水,属于化学变化,故 B 正确;C、只要功夫深,铁杵磨成针,只是将其磨细,没有新物质生成,属于物理变化,故 C错;D、夜来风雨声,花落知多少,只是花的吹落,没有新物质生成,属于物理变化,故 D错。故选:B。【点评】搞清楚物理变化和化学变化的本质区别是解答本类习题的关键。判断的标准是看在变化中有没有生成其他物质。一般地,物理变化有物质的固、液、气三态变化和物质形状的变化。2 (2 分) “绿水青山就是金山银山” 。下列倡议不符合该理念的是( )A秸杆就地焚
12、烧B合理施用化肥和农药C回收并集中处理废旧电池D用清洁能源替代化石燃料【分析】A、根据秸杆焚烧生成有害气体和烟尘等分析;第 8 页(共 22 页)B、根据合理施用化肥和农药能防止水体污染分析;C、根据废旧电池会污染水资源和土壤等分析;D、根据用清洁能源替代化石燃料能节约能源、减少污染分析。【解答】解:A、秸杆就地焚烧,能生成有害气体和烟尘等,会污染空气,不符合理念,B、合理施用化肥和农药,能防止水体污染,符合理念;C、回收并集中处理废旧电池,能防止水资源、土壤污染,符合理念;D、用清洁能源替代化石燃料,能节约能源、减少污染,符合该理念。故选:A。【点评】环保问题已经引起了全球的重视,关于“三废
13、”的处理问题,是中考的热点问题,化学上提倡绿色化学工艺,要从源头上杜绝污染。3 (2 分)下列物质不是氧化物的是( )A冰 B干冰 C臭氧 D过氧化氢【分析】物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物。氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,冰、干冰、过氧化氢都属于氧化物。【解答】解:A、氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,冰属于氧化物;故选项错误;B、氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,干冰是
14、二氧化碳的固体,属于氧化物;故选项错误;C、臭氧属于纯净物中的单质,不是氧化物;故选项正确;D、氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,过氧化氢属于氧化物;故选项错误;故选:C。【点评】本考点考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用。本考点的基础性比较强,主要出现在选择题和填空题中。4 (2 分)下列关于分子的说法不正确的是( )A分子在不断运动第 9 页(共 22 页)B分子之间有间隔C分子构成所有的物质D水分子保持水的化学性质【分析】根据构成物质的基本粒子、分子的概念与性质来分析解答。【解答】解:A分子是在不断运动的,故正
15、确;B分子之间有间隔,故正确;C并不是所有物质均由分子构成,有些物质是由原子或离子构成的,故错误;D分子是保持物质化学性质的最小粒子,水是由水分子构成的,所以水分子保持水的化学性质,故正确。故选:C。【点评】本题考查分子的知识,会利用分子原子的知识分析解决实际问题。5 (2 分)下列有关催化剂的说法正确的是( )A只能加快反应速率B二氧化锰在任何化学反应中都是催化剂C能增加生成物的质量D质量和化学性质在化学反应前后不变【分析】在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒) 。催化剂的特点可以概括为“一变二不变” ,一变是能够
16、改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变。【解答】解:A、催化剂能改变其他物质的化学反应速率,催化剂能加快化学反应速率,也可减慢某些化学反应的速率,故选项说法错误。B、二氧化锰不能做所有反应的催化剂,其它物质也可以作催化剂,故选项说法错误。C、催化剂只能改变化学反应速率,对生成物的质量无影响,使用催化剂不能增加生成物的质量,故选项说法错误。D、催化剂在化学反应前后质量和化学性质均不改变,故选项说法正确。故选:D。【点评】本题难度不大,考查对催化剂概念的理解,掌握催化剂的特征(“一变二不变”)是正确解答本题的关键。6 (2 分)下列灭火原理与“釜底抽薪”相同的是( )第
17、10 页(共 22 页)A锅内油着火用锅盖盖灭B用高压水枪喷水灭火C砍掉部分林木形成隔离带灭火D用二氧化碳灭火器灭火【分析】釜底抽薪体现的是一种常用的灭火方法,它利用的原理是清除可燃物,将锅底的柴火抽走,就没有了可燃物,起到灭火的作用。【解答】解:A用锅盖盖灭着火的油锅,是隔绝空气灭火,与“釜底抽薪”灭火原理不同,故错误;B用高压水枪灭火,是降温到可燃物的着火点以下灭火,与“釜底抽薪”灭火原理不同,故错误;C砍掉部分林木形成隔离带相当于清除了可燃物,达到灭火的目的,与“釜底抽薪”灭火原理相同,故正确;D用二氧化碳灭火,是利用二氧化碳不支持燃烧和密度大于空气的密度的原理,隔绝空气灭火,与“釜底抽
18、薪”灭火原理不同,故错误。故选:C。【点评】灭火的原理有:(1)清除可燃物或使可燃物与其他物品隔离;(2)隔绝氧气或空气;(3)使温度降到可燃物的着火点以下。7 (2 分)下列实验操作中存在错误的是( )A 检查气密性 B 检验氧气C 稀释浓硫酸 D 铁丝在氧气中燃烧【分析】A、根据检查装置气密性的方法进行分析判断。B、根据氧气的检验方法进行分析判断。C、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断。第 11 页(共 22 页)D、根据铁丝在氧气中燃烧的实验注意事项,进行分析判断。【解答】解:A、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气
19、泡冒出,装置不漏气;图中所示操作正确。B、检验氧气时,应将带火星的木条伸入集气瓶中,图中所示操作正确。C、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;图中所示操作正确。D、铁丝在氧气中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙,图中集气瓶的底部没有放少量的水或铺一层细沙,所示装置错误。故选:D。【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键。8 (2 分)已知化学反应:X+YSO 4Y+XSO 4,根据此反应信息判断正确的是(
20、)AX 一定是金属铁 BY 一定是金属铜CX 的金属活动性比 Y 强 DY 的金属活动性比 X 强【分析】根据金属活动性顺序表的应用分析判断,位于前面的金属能把后面的金属从其盐溶液中置换出来。【解答】解:A、由方程式可知金属活动性 XY,X 可能是金属铁,故错误;B、由方程式可知金属活动性 XY,Y 可能是金属铜,故错误。C、由方程式可知,X 能将 Y 从其盐溶液中置换出来,说明了 X 的金属活动性比 Y 强,故正确;D、由上述分析可知,Y 的金属活动性比 X 弱,故错误;故选:C。【点评】本题难度不大,明确位于前面的金属能把排在它后面的金属从其盐溶液中置换出来是正确解答本题的关键。9 (2
21、分)在 pH2 的无色溶液中,下列离子能大量共存的是( )ABa 2+、HCO 3 、SO 42 BAg +、Mg 2+、NO 3CK +、OH 、CO 32 DNH 4+、Fe 2+、Cl 【分析】pH 为 2 的水溶液显酸性,水溶液中含有大量的 H+;根据复分解反应的条件,第 12 页(共 22 页)离子间若能互相结合成沉淀、气体或水,则离子不能大量共存,据此进行分析判断即可。本题还要注意溶液呈无色,不能含有明显有颜色的铜离子、铁离子和亚铁离子等。【解答】解:pH 为 2 的水溶液显酸性,水溶液中含有大量的 H+;A、HCO 3 与酸性溶液中的 H+能结合生成水和二氧化碳,Ba 2+、SO
22、 42 能结合生成硫酸钡沉淀,不能大量共存,故选项错误。B、三种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,且不存在有色离子,故选项正确。C、OH 与酸性溶液中的 H+能结合成水,CO 32 与酸性溶液中的 H+能结合生成水和二氧化碳,不能大量共存,故选项错误。D、三种离子间不能结合成沉淀、气体或水,且能在酸性溶液中大量共存,但 Fe2+的水溶液呈浅绿色,故选项错误。故选:B。【点评】本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意是在酸性溶液中共存及特定离子的颜色。10 (2 分)将某稀硫酸分成两等份,分别向其


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2019 湖北省 荆州市 中考 化学 试卷 详细 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 荆州地理
- 2019年湖北省随州市中考化学试卷含详细答案
- 2019年湖北省宜昌市中考化学试卷含详细答案
- 2018年湖北省襄阳市中考化学试卷含详细答案
- 2019年湖北省仙桃市中考化学试卷含详细答案
- 2019年湖北省荆州市中考化学试卷含详细答案
- 2016年湖北省荆州市中考化学试卷及答案解析
- 2019年湖北省潜江市中考化学试卷含详细答案
- 2018年湖北省黄冈市中考化学试卷含详细答案
- 2019年湖北省鄂州市中考化学试卷含详细答案
- 2019年湖北省荆州市中考物理试卷含详细答案
- 2018年湖北省宜昌市中考化学试卷含详细答案
- 2019年湖北省襄阳市中考化学试卷含详细答案
- 2019年湖北省荆门市中考化学试卷含详细答案
- 2018年湖北省荆州市中考化学试卷含详细答案
- 2019年湖北省天门市中考化学试卷含详细答案
- 2017年湖北省荆州市中考英语试卷含答案
- 2019年湖北省咸宁市中考化学试卷含详细答案
- 湖北荆州



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-84915.html