 2019年辽宁省沈阳市中考化学试卷含详细答案
2019年辽宁省沈阳市中考化学试卷含详细答案
《2019年辽宁省沈阳市中考化学试卷含详细答案》由会员分享,可在线阅读,更多相关《2019年辽宁省沈阳市中考化学试卷含详细答案(27页珍藏版)》请在七七文库上搜索。
1、第 1 页(共 27 页)2019 年辽宁省沈阳市中考化学试卷一、选择题(本部分包括 13 道小题,1-11 小题,每题 1 分;12、13 小题,每题 2 分每小题只有一个最符合题目要求的选项 )1 (1 分)下列变化属于化学变化的是( )A谷物酿酒 B汽油挥发 C冰雪融化 D西瓜榨汁2 (1 分)下列关于物质用途的说法不正确的是( )A熟石灰用于改良酸性土壤B氮气用作灯泡填充气C液态氧用作火箭的可燃剂D食盐用作调味品3 (1 分)下列符号表示 2 个氢原子的是( )A2H 2 B2H CH 2 D2H 2O4 (1 分)下列实验操作中错误的是( )A 蒸发溶剂 B 取用固体C 滴加液体 D
2、 量取液体5 (1 分)下列叙述属于 CO 化学性质的是( )A无色 B无味 C难溶于水 D能燃烧6 (1 分)为预防甲状腺疾病,人体应补充的元素是( )A碘元素 B氟元素 C硒元素 D氯元素7 (1 分)下列物质属于化合物的是( )A氦气 B氯化钾 C空气 D金刚石8 (1 分)下列结构示意图表示阴离子的是( )第 2 页(共 27 页)A BC D9 (1 分)下列情况会造成环境污染的是( )A垃圾分类回收 B燃放烟花爆竹C增加绿地面积 D处理工业废气10 (1 分)下列早餐食物中富含蛋白质的是( )A鸡蛋 B青椒 C稀饭 D馒头11 (1 分)下列物质能用作磷肥的是( )ANH 4NO3
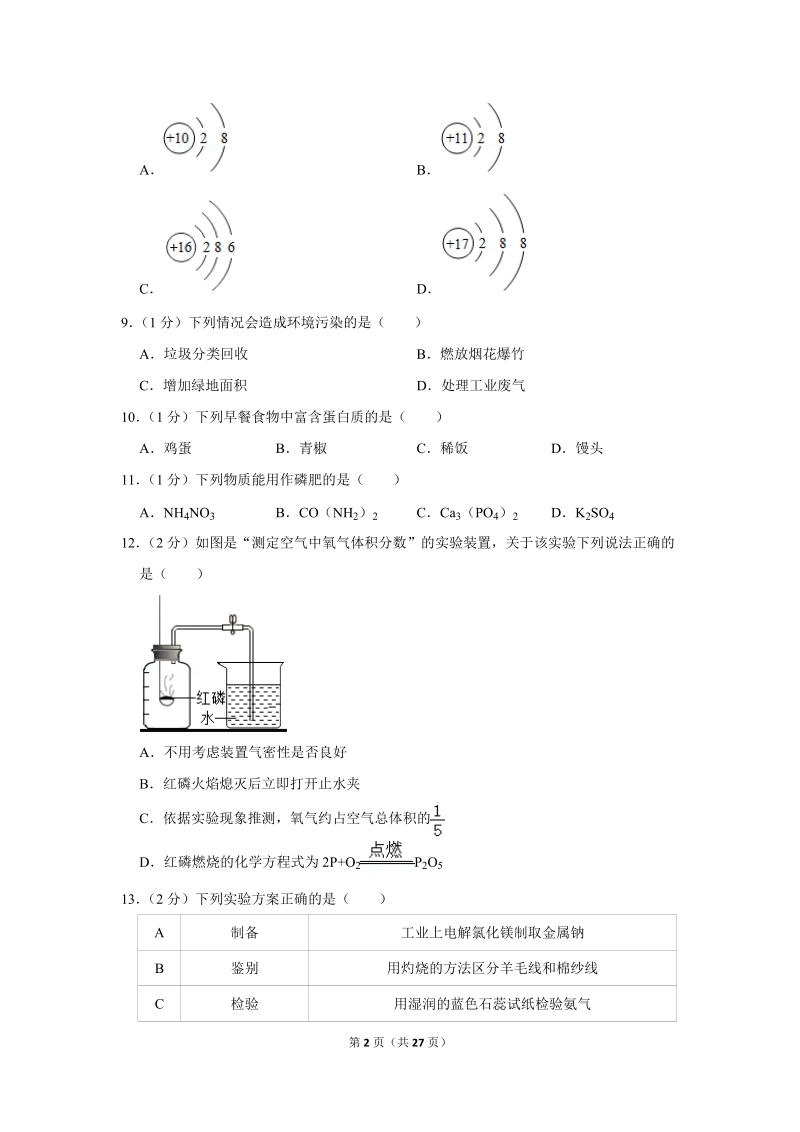
3、 BCO(NH 2) 2 CCa 3(PO 4) 2 DK 2SO412 (2 分)如图是“测定空气中氧气体积分数”的实验装置,关于该实验下列说法正确的是( )A不用考虑装置气密性是否良好B红磷火焰熄灭后立即打开止水夹C依据实验现象推测,氧气约占空气总体积的D红磷燃烧的化学方程式为 2P+O2 P2O513 (2 分)下列实验方案正确的是( )A 制备 工业上电解氯化镁制取金属钠B 鉴别 用灼烧的方法区分羊毛线和棉纱线C 检验 用湿润的蓝色石蕊试纸检验氨气第 3 页(共 27 页)D 除杂 用溶解、蒸发的方法除去粗盐中难溶性杂质AA BB CC DD二、非选择题(共 50 分)14 (4 分)
4、氢气与氧气在一定条件下可以发生化学反应。根据所给信息,请回答下列问题:(1)纯净的氢气在空气中燃烧时产生淡蓝色火焰、放出热量、烧杯内壁凝结有 ,写出发生反应的化学方程式 。(2)化学变化是反应物的 重新组合转变成生成物的过程。从氧气变为水时,氧元素化合价的具体变化是 。15 (8 分)NaOH 俗称火碱、烧碱、苛性钠,是常见的碱,请回答下列问题:(1)NaOH 的名称是 ,易溶于水,溶于水生成自由移动的 (填微粒符号) ,所以 NaOH 溶液能够导电。(2)向 NaOH 溶液中滴加稀硫酸,溶液的 pH (填”增大” 、 “减小”或“不变” )。(3)在试管中加入 2mL 10%NaOH 溶液,
5、滴加 5%CuSO4 溶液 45 滴,生成 色的 Cu(OH) 2 沉淀。用试管中的物质检验葡萄糖,发生如下反应:C6H12O6+2Cu(OH) 2+NaOH C6H11O7Na+Cu2O+3X ,推测 X 的化学式为 。(4)参考如图,在( )内画出“”或“”补全图例(“”表示物质间转化,“”表示物质间相互反应) 。请写出图例中,能发生复分解反应的化学方程式: (写出一个即可) 。第 4 页(共 27 页)16 (9 分)如图是实验室制取气体的常用装置,请回答下列问题:(1)写出图中标号仪器的名称: 。(2)实验室可用过氧化氢溶液与 MnO2 制取 O2,该反应中 MnO2 是 ,请写出该反
6、应的化学方程式: 。若用 E 装置收集 O2,当 时,开始收集。(3)实验室可用 Zn 粒与稀硫酸制取 H2应选用的气体发生装置是 (填字母) ,该装置优点为 。若要收集干燥的 H2,应将生成的 H2 依次通过 F、D 装置,F 装置中盛放的液体是 (填名称) ,选择 D 装置收集 H2 的原因是 (填 H2 的物理性质) 。17 (4 分)如图为 KNO3、NaCl 两种固体物质的溶解度曲线,请回答下列问题:(1)10时 KNO3 的溶解度 (填“、 “或“” )NaCl 的溶解度。第 5 页(共 27 页)(2)80时 140g KNO3 溶于 100g 水中形成的溶液是 (填“饱和”或“
7、不饱和” )溶液。(3)如图所示进行实验,再现结晶过程:本实验条件下,影响析出晶体质量多少的主要因素是 、 。18 (14 分)化学是一门实用的基础科学,在人类社会的发展历程中起着重要作用。正确认识物质人们在实验研究中总结出常见金属的活动性顺序:(1)请在表中内填写对应的元素符号。(2)Mg、Sn、 Pt、Au 四种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有 种。(3)Cu 能从 AgNO3 溶液中置换出 Ag,请说明理由: 。合理利用资源(1)工业上用含氧化铁 480t 的赤铁矿为原料炼铁,得到含杂质 4%的生铁 t。(2)化学小组通过实验将生锈铁钉回收处理。【铁钉处理】实验过程 实验
8、现象 实验原理 保存方法a向盛有生锈铁钉的烧杯中加入稀盐酸,浸没铁钉溶液由无色变为黄色、铁钉表面有气泡产生、铁锈脱落b取出铁钉,洗涤、干燥,妥善保管铁钉呈现银白色请写出稀盐酸除铁锈的化学方程式:写出一条防止铁制品生锈的方法:(3)小组同学提出,烧杯中的废液也可以回收处理。【废液处理】同学们查阅相关资料,获知:第 6 页(共 27 页)aFe 2O3 是一种红棕色粉末,俗称铁红,常用作红色油漆和涂料。bFeCl 2+2NaOHFe(OH) 2+2NaClc.4Fe(OH) 2+O2+2H2O4Fe (OH ) 3d不溶性碱受热易分解,生成对应的金属氧化物和水。实验流程:悬浊液 A 静置一天的原因
9、是 。操作 I 是 。写出固体 C 转化为铁红的化学方程式 。促进科技发展化学学科在合成药物等方面发挥若巨大作用,以下是几种常见的合成药物,请根据信息回答下列问题:(1)解热镇痛药阿司匹林是人们熟知的治感冒药,具有解热镇痛作用,化学式为 C9H8O4,相对分子质量是 。(2)抗生素青霉素是最重要的抗生素,即消炎药,能治疗肺炎和外伤感染等。青霉素中用得较多的是青霉素钠,化学式为 C16H17O4N2SNa,其中氢、氧元素质量比为 。(3)抗酸药抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部不适。抗酸药的种类很多,通常含有一种或几种化学物质,如 NaHCO3、MgCO 3、Mg(OH)
10、 2 等。请写出其中一个与盐酸反应的化学方程式 。19 (11 分)某化学小组对石灰石灼烧后得到的固体进行相关探究。成分分析(1)检验灼烧过程中产生的新物质根据已有知识和经验判断:石灰石灼烧后固体中含有 CaO,判断的依据是 (用化学方程式表示) 。第 7 页(共 27 页)设计实验方案进行验证:实验内容 实验现象实验分析取灼烧后固体放入盛有冷水的烧杯中,充分搅拌静置后,取少量上层澄清的液体置于试管中,向其中滴加 2 滴酚酞试液溶液由无色变为 色反应后生成碱,请写出该反应的化学方程式: (2)检验灼烧后固体中是否含有 CaCO3向盛有灼烧后固体的烧杯中滴加稀盐酸,有气泡产生,证明 。数据分析用
11、反应前后质量差计算灼烧后固体中 CaCO3 的质量分数化学小组设计以下两个实验方案,方案中反应前后质量差分别用 m1 与 m2 表示。 (两方案中实验操作误差忽略不计,取用的灼烧后固体成分均匀、质量相等,固体中除CaO、CaCO 3 其余成分均不发生反应,所用稀盐酸经估算确保足量)数据测量 数据处理实验方案反应前 反应后 反应前后质量差方案一:取灼烧后固体放入烧杯中,加入稀盐酸充分反应,不再产生气泡灼烧后固体的质量、所用稀盐酸质量烧杯中剩余物质的质量m1方案二:取灼烧后固体继续灼烧,至固体的质量不再改变灼烧后固体的质量 剩余固体的质量m2结合信息,比较 m1 与 m2 的关系。请写出两种不同猜
12、想并分别说明理由。猜想 1 及理由: 。猜想 2 及理由: 。经分析选择合理的实验方案,进行计算拓展研究如图的酒精灯和酒精喷灯是常用的加热仪器,请回答下列问题:第 8 页(共 27 页)(1)酒精灯是玻璃仪器,火焰温度通常可达 300500, (填“焰心“、 “内焰”或“外焰” )温度最高。熄灭酒精灯的方法是 ,采用此方法灭火的原理是 。(2)酒精喷灯一般是铜质仪器,火焰温度通常可达 8001000使用酒精喷灯时应先向引火碗内注入 容量的酒精,用火柴将引火碗内酒精点燃,点燃引火碗内酒精的目的是 、 。第 9 页(共 27 页)2019 年辽宁省沈阳市中考化学试卷参考答案与试题解析一、选择题(本
13、部分包括 13 道小题,1-11 小题,每题 1 分;12、13 小题,每题 2 分每小题只有一个最符合题目要求的选项 )1 (1 分)下列变化属于化学变化的是( )A谷物酿酒 B汽油挥发 C冰雪融化 D西瓜榨汁【分析】有新物质生成的变化属于化学变化,没有新物质生成的变化属于物理变化,判断化学变化的唯一标准是有新物质生成。【解答】解:A、谷物酿酒过程中生成酒精等物质,是化学变化;B、汽油挥发过程中没有生成新物质,是物理变化;C、冰雪融化过程中没有生成新物质,是物理变化;D、西瓜榨汁过程中没有生成新物质,是物理变化。故选:A。【点评】判断变化是否属于化学变化的唯一标准是:是否有新物质生成,如果有
14、新物质生成,就是化学变化,如果没有新物质生成,就不是化学变化。2 (1 分)下列关于物质用途的说法不正确的是( )A熟石灰用于改良酸性土壤B氮气用作灯泡填充气C液态氧用作火箭的可燃剂D食盐用作调味品【分析】氢氧化钙能和酸应生成盐和水;氮气化学性质不活泼;氧气能够支持燃烧,不能燃烧,因此不能用作燃料;氯化钠有咸味,可以用作调味品。【解答】解:A、氢氧化钙是碱,可以用作改良酸性土壤,该选项说法正确;B、氮气化学性质不活泼,因此氮气可以用作灯泡填充气,该选项说法正确;C、氧气能够支持燃烧,但是不能燃烧,该选项说法不正确;D、食盐有咸味,可以用作调味品,该选项说法正确。故选:C。第 10 页(共 27
15、 页)【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。3 (1 分)下列符号表示 2 个氢原子的是( )A2H 2 B2H CH 2 D2H 2O【分析】元素符号可以表示一种元素,还可以表示该元素的 1 个原子,有时还可以表示一种物质,例如金属元素的元素符号可以表示该金属,稀有气体的元素符号可以表示稀有气体的单质;物质的化学式可以表示一种物质,该物质的元素组成,该物质的 1 个分子,每个分子的原子构成。【解答】解:A、2H 2 表示 2 个氢分子;B、2H 表示 2 个氢原子;C、H 2 表示氢气、氢气由氢元素组成、1 个氢分子、1
16、 个氢分子由 2 个氢原子构成;D、2H 2O 表示 2 个水分子。故选:B。【点评】本题主要考查学生对化学用语的理解能力,题目重点考查了对化学符号意义的了解,考查全面,注重基础,题目难度较小。4 (1 分)下列实验操作中错误的是( )A 蒸发溶剂 B 取用固体C 滴加液体 D 量取液体【分析】A、根据蒸发操作的注意事项进行分析判断。B、根据向试管中装粉末状固体药品的方法(“一斜、二送、三直立” )进行分析判断。C、根据使用胶头滴管滴加少量液体的方法进行分析判断。D、根据量筒读数时视线要与凹液面的最低处保持水平进行分析判断。【解答】解:A、蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液
17、体飞溅,第 11 页(共 27 页)图中所示操作正确。B、取用粉末状药品,试管横放,用药匙或纸槽把药品送到试管底部,图中所示操作正确。C、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误。D、量筒读数时视线要与量筒内液体的凹液面的最低处保持水平,图中所示操作正确。故选:C。【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键。5 (1 分)下列叙述属于 CO 化学性质的是( )A无色 B无味 C难溶于水 D能燃烧【分析】需要通过化学变化表现出来的性
18、质,属于物质的化学性质,不需要通过化学变化表现出来的性质,属于物质的物理性质。【解答】解:A物质的颜色不需要通过化学变化表现出来,属于物质的物理性质;B物质的气味不需要通过化学变化表现出来,属于物质的物理性质;C物质的溶解性不需要通过化学变化表现出来,属于物质的物理性质;D物质能够燃烧,需要通过化学变化表现出来,属于物质的化学性质;故选:D。【点评】物理性质、化学性质是一对与物理变化、化学变化有密切关系的概念,联系物理变化、化学变化来理解物理性质和化学性质,则掌握起来并不困难。6 (1 分)为预防甲状腺疾病,人体应补充的元素是( )A碘元素 B氟元素 C硒元素 D氯元素【分析】根据化学元素与人
19、体健康的关系来分析解答。【解答】解:人体内缺乏碘元素易患甲状腺疾病,所以为预防甲状腺疾病,人体应补充碘元素。故选:A。【点评】熟记各种物质中所含元素的种类,知道缺少什么元素得什么病。7 (1 分)下列物质属于化合物的是( )A氦气 B氯化钾 C空气 D金刚石【分析】纯净物由一种物质组成,混合物由两种或两种以上的物质组成;第 12 页(共 27 页)单质是由一种元素组成的纯净物,化合物是由不同种元素组成的纯净物;【解答】解:A、氦气是由一种物质组成,属于单质;B、氯化钾是由钾元素和氯元素组成的纯净物,属于化合物;C、空气中含有氮气、氧气等物质,属于混合物;D、金刚石由碳一种物质组成组成,属于单质
20、。故选:B。【点评】判断纯净物和混合物时,就是判断物质的物质组成;判断是否是单质、化合物、氧化物时,既要判断元素组成,又要判断物质组成。8 (1 分)下列结构示意图表示阴离子的是( )A BC D【分析】根据核内质子数等于核外电子数属于原子;核内质子数小于核外电子数属于阴离子;阴离子是得了电子,带负电荷的粒子,核内质子数小于核外电子数解答。【解答】解:A该粒子中,质子数核外电子数,属于原子,故错误;B该粒子中,质子数核外电子数,属于阳离子,故错误;C该粒子中,质子数核外电子数,属于原子,故错误;D该粒子中,质子数核外电子数,属于阴离子,故正确。故选:D。【点评】解答本题的关键是要根据阴离子的特
21、点:核内质子数小于核外电子数。9 (1 分)下列情况会造成环境污染的是( )A垃圾分类回收 B燃放烟花爆竹C增加绿地面积 D处理工业废气【分析】根据造成环境污染的因素来分析解答。【解答】解:A垃圾分类回收有助于保护环境质量;B燃放烟花爆竹会产生烟尘、有害气体等空气污染物,还会产生噪声污染;第 13 页(共 27 页)C增加绿地面积有利于改善环境质量;D将工业废弃处理达标后再排放有利于保护空气的质量。故选:B。【点评】污染是个与发展有关的定义,广义污染是对原有的打破都是污染,限于经济水平等要素影响,我们目前只是从特定指标方面方面进行污染的检测与控制。10 (1 分)下列早餐食物中富含蛋白质的是(
22、 )A鸡蛋 B青椒 C稀饭 D馒头【分析】根据营养素的食物来源进行分析解答。【解答】A鸡蛋富含蛋白质,故 A 正确;B青椒富含维生素,故 B 错误;C稀饭富含糖类,故 C 错误;D馒头富含糖类,故 D 错误。故选:A。【点评】本题难度不大,掌握各种营养素的生理功能、食物来源等是正确解答此类题的关键。11 (1 分)下列物质能用作磷肥的是( )ANH 4NO3 BCO(NH 2) 2 CCa 3(PO 4) 2 DK 2SO4【分析】含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥,同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥。【解答】解:A、NH 4
23、NO3 中含有氮元素,属于氮肥。B、CO(NH 2) 2 中含有氮元素,属于氮肥。C、Ca 3(PO 4) 2 中含有磷元素,属于磷肥。D、K 2SO4 中含有钾元素,属于钾肥。故选:C。【点评】本题主要考查化肥的分类方面的知识,确定化肥中营养元素的种类、化肥的分类方法是正确解答此类题的关键。12 (2 分)如图是“测定空气中氧气体积分数”的实验装置,关于该实验下列说法正确的是( )第 14 页(共 27 页)A不用考虑装置气密性是否良好B红磷火焰熄灭后立即打开止水夹C依据实验现象推测,氧气约占空气总体积的D红磷燃烧的化学方程式为 2P+O2 P2O5【分析】在装有空气的密闭容器中,欲用燃烧法
24、测定空气中氧气含量,该实验一般要注意以下几点:装置的气密性好; 所用药品必须是足量; 读数时一定要冷却到原温度; 所选除氧剂要具备以下特征:本身能够在空气中燃烧;本身的状态为非气体;生成的物质为非气态;据此进行分析判断。【解答】解:A实验前,应先检验装置的气密性,以防止装置漏气,造成测定结果不准确,故选项说法错误。B红磷熄灭后,冷却后打开弹簧夹,以防止剩余的气体在受热状态下,处于膨胀状态,占据了部分水的体积,故选项说法错误。C足量的红磷燃烧耗尽了装置内的氧气,实验结束,装置冷却至室温后,打开止水夹,进入集气瓶内水的体积约占集气瓶容积的五分之一,由此现象可推知,氧气约占空气体积的五分之一,故正确

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2019 辽宁省 沈阳市 中考 化学 试卷 详细 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 沈阳126七年级月考答案
- 沈阳市第三十一中学
- 沈阳市第五十六中学
- 2018年广州市中考化学试卷
- 2020年辽宁省沈阳市中考化学试卷
- 辽宁省沈阳市沈河区2017-2018地理期末
- 沈阳2021年一模化学
- 辽宁省康平县高级中学
- 辽宁省北票市高级中学
- 辽宁中考
- 2021辽宁省沈阳市中考数学试卷
- 2016年辽宁省沈阳市中考化学试卷及答案解析
- 2019年辽宁省本溪市中考化学试卷含详细答案
- 2019年辽宁省阜新市中考化学试卷含详细答案
- 2018年辽宁省盘锦市中考化学试卷含详细答案
- 2018年辽宁省锦州市中考化学试卷含详细答案
- 2019年辽宁省沈阳市中考化学试卷含详细答案
- 2019年辽宁省营口市中考化学试卷含详细答案
- 2018年辽宁省沈阳市中考化学试卷含详细答案
- 2019年辽宁省辽阳市中考化学试卷含详细答案



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-82629.html