 沪教版九年级化学《7.2常见的酸和碱》同步练习(含答案)
沪教版九年级化学《7.2常见的酸和碱》同步练习(含答案)
《沪教版九年级化学《7.2常见的酸和碱》同步练习(含答案)》由会员分享,可在线阅读,更多相关《沪教版九年级化学《7.2常见的酸和碱》同步练习(含答案)(4页珍藏版)》请在七七文库上搜索。
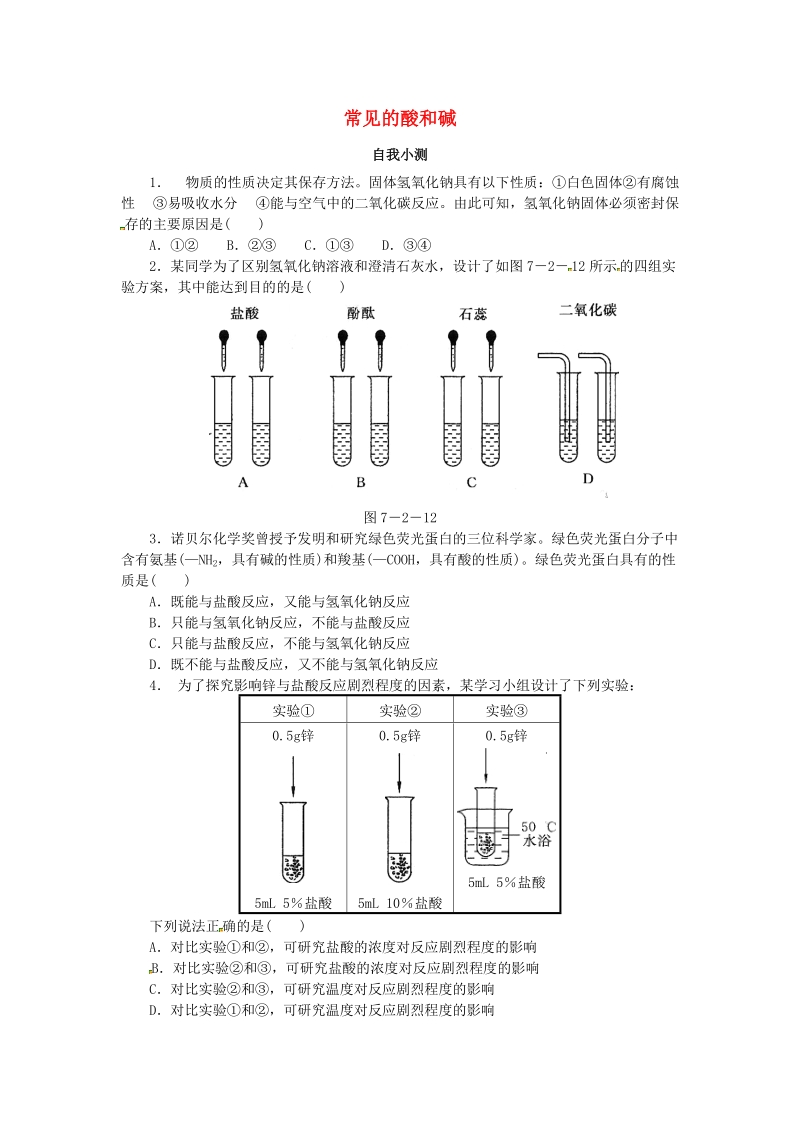
1、常见的酸和碱自我小测1 物质的性质决定其保存方法。固体氢氧化钠具有以下性质:白色固体有腐蚀性 易吸收水分 能与空气中的二氧化碳反应。由此可知,氢氧化钠固体必须密封保存的主要原因是( )A B C D2某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如图 72 12 所示 的四组实验方案,其中能达到目的的是( )图 72123诺贝尔化学奖曾授予发明和研究绿色荧光蛋白的三位科学家。绿色荧光蛋白分子中含有氨基(NH 2,具有碱的性质)和羧基(COOH,具有酸的性质)。绿色荧光蛋白具有的性质是( )A既能与盐酸反应,又能与氢氧化钠反应B只能与氢氧化钠反应,不能与盐酸反应C只能与盐酸反应,不能与氢氧化钠反
2、应D既不能与盐酸反应,又不能与氢氧化钠反应4 为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验:实验 实验 实验0.5g锌5mL 5盐酸0.5g锌5mL 10盐酸0.5g锌5mL 5盐酸下列说法正 确的是( )A对比实验和,可研究盐酸的浓度对反应剧烈程度的影响B对比实验和,可研究盐酸的浓度对反应剧烈程度的影响C对比实验和,可研究温度对反应剧烈程度的影响D对比实验和,可研究温度对反应剧烈程度的影响5下列离子组能在 pH1 的无色溶液中大量共存的是( )A Fe3 Na OH BK Na NO 24SO3NCCl K Ba2 DCa 2 Cl Na4S 2C6将某金属 M 置于硫酸
3、锌溶液中,无明显现象发生;而将其置于硫酸铜溶液中时,表面有红色固体物质析出。由此可判断 M、Zn、Cu 的金属活动性由强到弱的顺序为( )AM、Zn、Cu BZn、M、Cu CZn、Cu、M DCu、M、Zn7某校实验室有一批生锈的铁架台,该校初三(1)班化学兴趣小组设计了一个铁架台翻新“三步骤”方案:用砂纸打磨铁架台;用适量稀酸清洗,水洗,晾干;防锈处理。请回答:(1)的目的是_。(2)中所用的稀酸是_,其除锈的化学方程式为_。(3)写出的具体做法: _。8某工厂欲从只含有 CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:(1)操作 a、b 的名称分别是_、_。(2)写
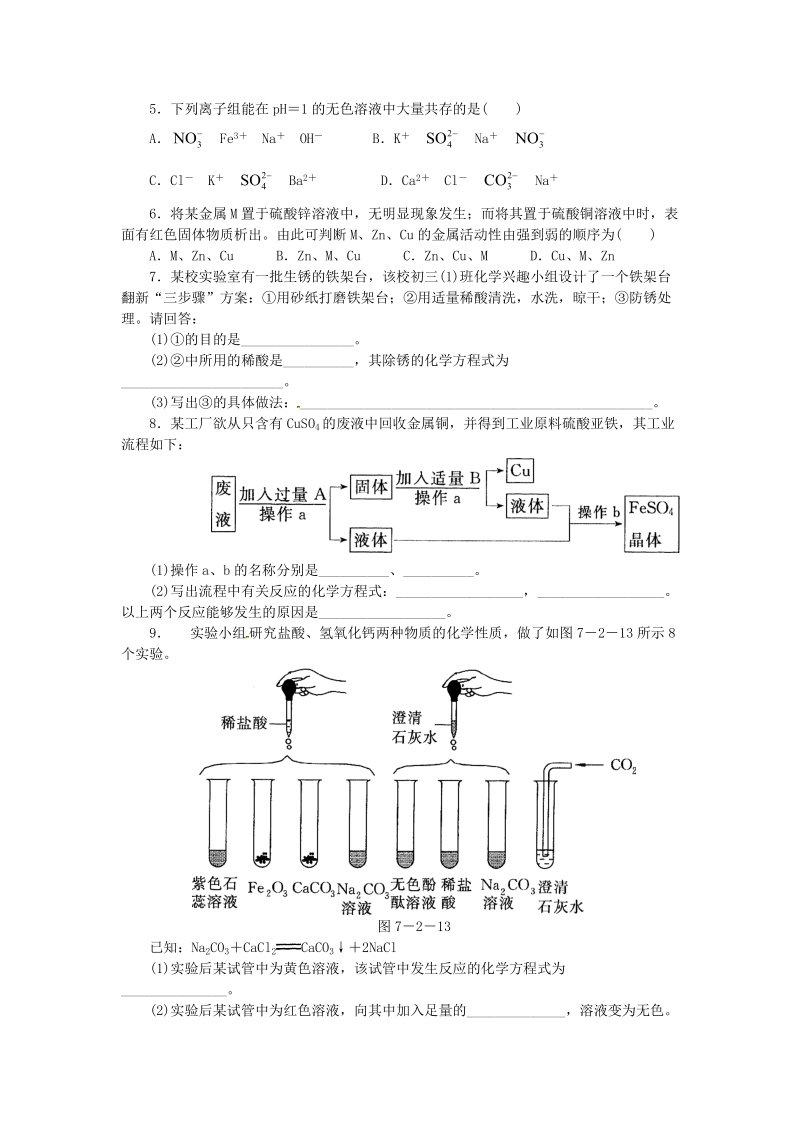
4、出流程中有关反应的化学方程式:_,_。以上两个反应能够发生的原因是_。9 实验小组 研究盐酸、氢氧化钙两种物质的化学性质,做了如图 7213 所示 8个实验。图 7213已知:Na 2CO3CaCl 2 CaCO32NaCl(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为_。(2)实验后某试管中为红色溶液,向其中加入足量的_,溶液变为无色。由此推断,该试管中最初盛有的物质是_。(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现。由此推断,该试管中最初发生反应的化学方程式为_。(4)实验后某试管中只得到无色溶液,向其中加入足量的 Na2CO3溶液,无

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 沪教版 九年级 化学 7.2 常见 同步 练习 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-72562.html