 2019年全国卷Ⅲ理综化学高考试题含答案(Word版)
2019年全国卷Ⅲ理综化学高考试题含答案(Word版)
《2019年全国卷Ⅲ理综化学高考试题含答案(Word版)》由会员分享,可在线阅读,更多相关《2019年全国卷Ⅲ理综化学高考试题含答案(Word版)(9页珍藏版)》请在七七文库上搜索。
1、绝密启用前2019 年普通高等学校招生全国统一考试理科综合能力测试注意事项:1答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。2回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 。3考试结束后,将本试卷和答题卡一并交回。可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:本题共 13 个小题,每小题 6 分。共 78 分,在每小题给出的四个选项中,只有一项是符合题
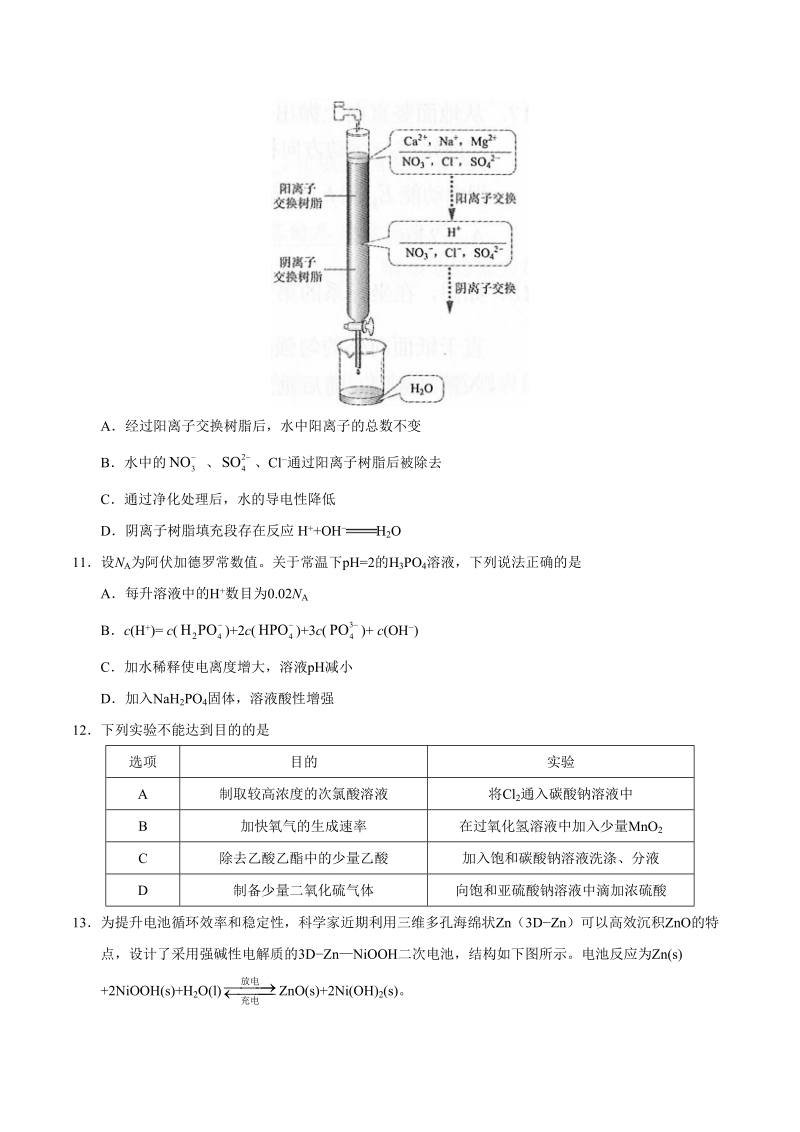
2、目要求的。7化学与生活密切相关。下列叙述错误的是A高纯硅可用于制作光感电池B铝合金大量用于高铁建设C活性炭具有除异味和杀菌作用D碘酒可用于皮肤外用消毒8下列化合物的分子中,所有原子可能共平面的是A甲苯 B乙烷 C丙炔 D1,3丁二烯9X、Y、Z 均为短周期主族元素,它们原子的最外层电子数之和我 10,X 与 Z 同族,Y 最外层电子数等于 X 次外层电子数,且 Y 原子半径大于 Z。下列叙述正确的是A熔点:X 的氧化物比 Y 的氧化物高B热稳定性:X 的氢化物大于 Z 的氢化物CX 与 Z 可形成离子化合物 ZXDY 的单质与 Z 的单质均能溶于浓硫酸10离子交换法净化水过程如图所示。下列说法
3、中错误的是A经过阳离子交换树脂后,水中阳离子的总数不变B水中的 、 、Cl 通过阳离子树脂后被除去3NO24SC通过净化处理后,水的导电性降低D阴离子树脂填充段存在反应 H+OH H2O11设N A为阿伏加德罗常数值。关于常温下pH=2的H 3PO4溶液,下列说法正确的是A每升溶液中的H +数目为0.02N ABc(H +)= c( )+2c( )+3c( )+ c(OH)42PO434PC加水稀释使电离度增大,溶液pH减小D加入NaH 2PO4固体,溶液酸性增强12下列实验不能达到目的的是选项 目的 实验A 制取较高浓度的次氯酸溶液 将Cl 2通入碳酸钠溶液中B 加快氧气的生成速率 在过氧化
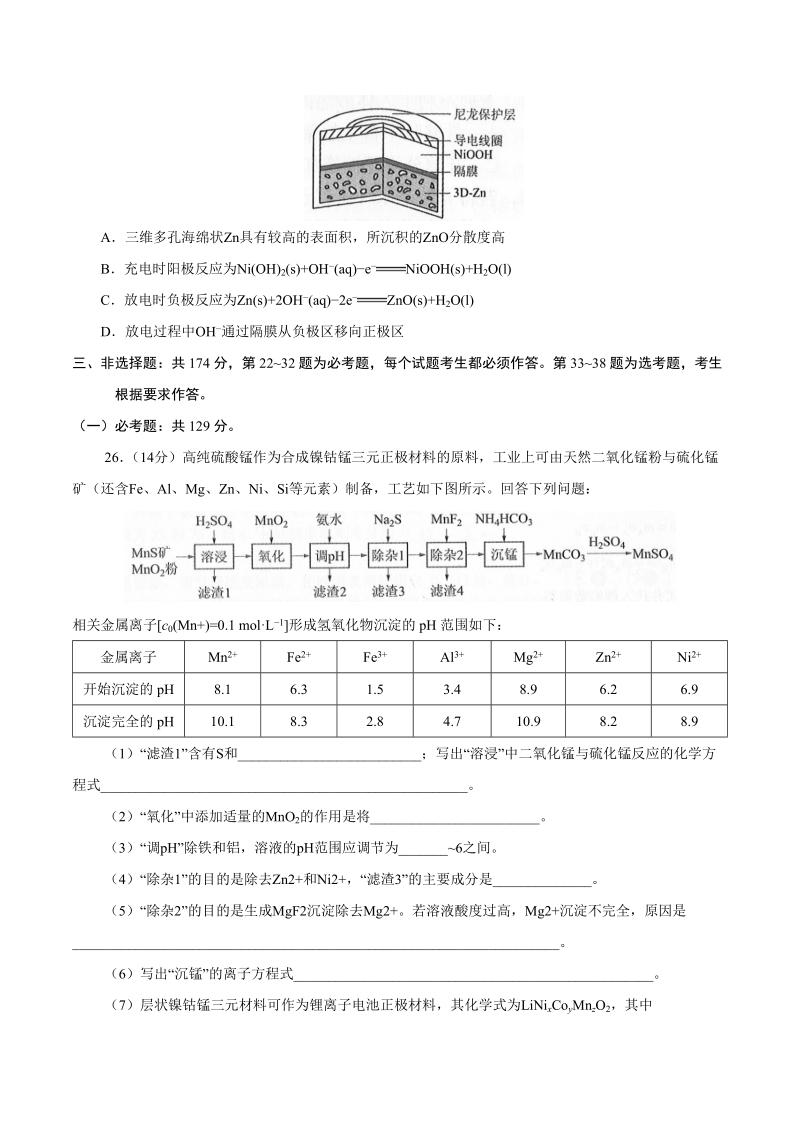
4、氢溶液中加入少量MnO 2C 除去乙酸乙酯中的少量乙酸 加入饱和碳酸钠溶液洗涤、分液D 制备少量二氧化硫气体 向饱和亚硫酸钠溶液中滴加浓硫酸13为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZnNiOOH二次电池,结构如下图所示。电池反应为 Zn(s)+2NiOOH(s)+H2O(l) ZnO(s)+2Ni(OH)2(s)。 放 电充 电A三维多孔海绵状Zn具有较高的表面积,所沉积的 ZnO分散度高B充电时阳极反应为Ni(OH) 2(s)+OH(aq)e NiOOH(s)+H2O(l)C放电时负极反应为Zn(s)+
5、2OH (aq)2e ZnO(s)+H2O(l)D放电过程中OH 通过隔膜从负极区移向正极区三、非选择题:共 174 分,第 2232 题为必考题,每个试题考生都必须作答。第 3338 题为选考题,考生根据要求作答。(一)必考题:共 129 分。26 (14分)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:相关金属离子c 0(Mn+)=0.1 molL1形成氢氧化物沉淀的 pH 范围如下:金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+开始沉淀的 p
6、H 8.1 6.3 1.5 3.4 8.9 6.2 6.9沉淀完全的 pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9(1)“滤渣1”含有S和_;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_。(2)“氧化”中添加适量的MnO 2的作用是将_。(3)“调pH”除铁和铝,溶液的pH范围应调节为_6之间。(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_。(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_。(6)写出“沉锰” 的离子方程式_。(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNi
7、xCoyMnzO2,其中Ni、Co、Mn 的化合价分别为+2、+3、+4。当x=y= 时, z=_。1327 (14分)乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:水杨酸 醋酸酐 乙酰水杨酸熔点/ 157159 -72-74 135138相对密度 /( gcm3) 1.44 1.10 1.35相对分子质量 138 102 180实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐 10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 左右,充分反应。稍冷后进行如下操作.在不断搅拌下将反应后的混合物倒

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2019 全国卷 化学 高考 试题 答案 Word
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 2019全国卷1生物
- 2019年化学全国卷二卷
- 2019年化学全国卷卷
- 2020化学高考模拟自测卷含答案解析
- 2021年YX全国卷
- 一模高考试题
- 2019年全国卷理数高考试题word版含答案
- 2011全国卷二
- 2021年化学高考真题分类
- 2021年试冲刺预测全国卷(六) YX版各科试题及答案
- 2019年全国卷二文综历史选择题分析
- 2020化学高考全国2卷
- 2020浙江高考试题
- 2019年全国卷理综高考试题含答案Word版
- 2019年全国卷语文高考试题含答案Word版
- 2019年全国卷英语高考试题含答案Word版
- 2019年全国卷文综地理高考试题含答案Word版
- 2019年全国卷文综政治高考试题含答案Word版
- 2019年全国卷理数高考试题含答案Word版
- 2019年全国卷高考英语试题含答案Word版



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-66015.html