 湖南师大附中2019届高考理科综合模拟试卷(二)含答案解析
湖南师大附中2019届高考理科综合模拟试卷(二)含答案解析
《湖南师大附中2019届高考理科综合模拟试卷(二)含答案解析》由会员分享,可在线阅读,更多相关《湖南师大附中2019届高考理科综合模拟试卷(二)含答案解析(23页珍藏版)》请在七七文库上搜索。
1、炎德英才大联考湖南师大附中 2019 届高考模拟卷(二)理科综合能力测试时量:150 分钟 满分:300 分本试卷分第卷(选择题)和第卷(非选择题) 两部分。其中第卷 3338 题为选考题,其他题为必考题。考试结束后,将本试卷和答题卡一并交回。可能用到的相对原子质量:H 1 B11 C12 O16 Na23 Cu64第卷一、选择题:本题共 13 小题,每小题 6 分,在每小题给出的四个选项中,只有一项是符合题目要求的。1下列关于 DNA 和 RNA 的叙述 ,正确的是(C)ADNA 是脱氧核苷酸的简称,RNA 是核糖核苷酸的简称B生物体内合成蛋白质时, DNA 仅作为转录模板、RNA 仅作为翻
2、译模板C细胞分化过程中,核 DNA 种类没有发生改变,但 RNA 种类发生了变化D观察 DNA 和 RNA 在细胞中的分布,可用吡罗红健那绿给鸭梨果肉细胞染色【解析】A 项中应去掉“苷” 字;B 项中 RNA 除了 mRNA 作为翻译模板,还有 tRNA和 rRNA 在翻译中起作用;D 项中“健那绿”是染线粒体的。2下列有关细胞中“基本骨(支) 架”的叙述,错误的是(C)A生物大分子由单体连接而成 ,单体则以碳链为基本骨架B细胞膜的基本支架是磷脂双分子层,呈轻油般的流体状态C双链 DNA 的稳定性,与脱氧核糖和磷酸通过氢键连成的基本骨架有关D由蛋白质纤维组成的细胞骨架 ,与细胞物质运输、能量转
3、换、信息传递等有关【解析】脱氧核糖和磷酸是通过磷酸二酯键连成的。3下列有关细胞生命历程的说法,错误的是(A)A随着细胞生长,细胞表面积增大 ,物质运输效率升高B细胞内多种酶活性降低、色素积累等,都是细胞衰老的特征C细胞凋亡受到严格的由遗传机制决定的程序性调控D用光学显微镜观察细胞形态发生改变是判断细胞癌变的依据之一【解析】随着细胞生长,细胞表面积虽然增大了,但与细胞体积相比,相对表面积还减小了,物质运输的效率也相对降低了。4下列有关植物激素的叙述,错误的是(D)A植物激素是由植物体一定部位产生 ,调节植物生命活动的微量物质B赤霉素具有促进果实发育,解除种子休眠,促进种子萌发的作用C脱落酸的主要
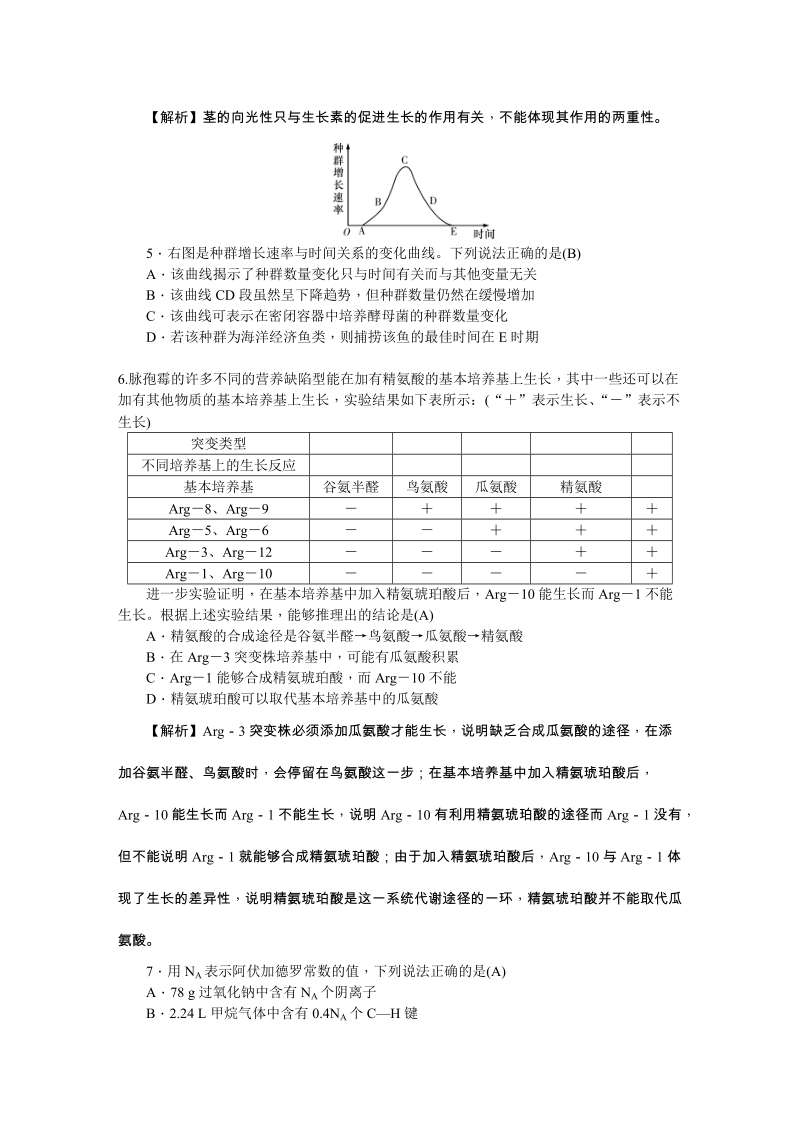
4、作用是抑制细胞分裂,促进叶和果实的衰老和脱落D植物根的向地性、茎的向光性等现象 ,都体现了生长素作用的两重性【解析】茎的向光性只与生长素的促进生长的作用有关,不能体现其作用的两重性。5右图是种群增长速率与时间关系的变化曲线。下列说法正确的是(B)A该曲线揭示了种群数量变化只与时间有关而与其他变量无关B该曲线 CD 段虽然呈下降趋势 ,但种群数量仍然在缓慢增加C该曲线可表示在密闭容器中培养酵母菌的种群数量变化D若该种群为海洋经济鱼类 ,则捕捞该鱼的最佳时间在 E 时期6.脉孢霉的许多不同的营养缺陷型能在加有精氨酸的基本培养基上生长,其中一些还可以在加有其他物质的基本培养基上生长,实验结果如下表所
5、示:(“”表示生长、 “”表示不生长)突变类型不同培养基上的生长反应基本培养基 谷氨半醛 鸟氨酸 瓜氨酸 精氨酸Arg8、Arg9 Arg5、Arg6 Arg3、Arg12 Arg1、Arg10 进一步实验证明,在基本培养基中加入精氨琥珀酸后,Arg10 能生长而 Arg1 不能生长。根据上述实验结果,能够推理出的结论是(A)A精氨酸的合成途径是谷氨半醛 鸟氨酸瓜氨酸精氨酸B在 Arg3 突变株培养基中,可能有瓜氨酸积累CArg1 能够合成精氨琥珀酸,而 Arg10 不能D精氨琥珀酸可以取代基本培养基中的瓜氨酸【解析】Arg 3 突变株必须添加瓜氨酸才能生长 ,说明缺乏合成瓜氨酸的途径 ,在添
6、加谷氨半醛、鸟氨酸时,会停留在鸟氨酸这一步;在基本培养基中加入精氨琥珀酸后,Arg10 能生长而 Arg1 不能生长 ,说明 Arg10 有利用精氨琥珀酸的途径而 Arg1 没有,但不能说明 Arg1 就能够合成精氨琥珀酸;由于加入精氨琥珀酸后,Arg 10 与 Arg1 体现了生长的差异性,说明精氨琥珀酸是这一系统代谢途径的一环,精氨琥珀酸并不能取代瓜氨酸。7用 NA 表示阿伏加德罗常数的值,下列说法正确的是(A)A78 g 过氧化钠中含有 NA 个阴离子B2.24 L 甲烷气体中含有 0.4NA 个 CH 键C0.1 mol 熔融 NaHSO4 能电离产生 1NA 个 SO 离子24D将
7、1 mL 0.1 mol/L FeCl3 溶液滴入沸水中可生成含有 1.0104 NA 个 Fe(OH)3 胶粒的胶体8下列说法正确的是(B)A糖类俗称碳水化合物,其组成都符合通式 Cm(H2O)nB天然蛋白质是高分子化合物,其水解产物氨基酸具有两性C生物柴油和传统柴油成分相同,可以实现能源替代,大力发展生物柴油对控制城市大气污染具有重要的战略意义D淀粉发酵酿酒的原理可以表达为 (C6H10O5)n4nH 2O 3nC2H5OH3nO 2 酒 化 酶 92018 年 12 月 26 日,北京交通大学东校区 2 号楼实验室内学生进行垃圾渗滤液污水处理科研试验时发生爆炸。经核实,事故造成 3 名参
8、与实验的学生死亡。实验规则千万条,安全第一条,下列说法正确的是(C)A实验室发生火灾时,应尽快用水扑灭B实验室中金属钠应置于煤油中保存,白磷应置于干燥容器中妥善保管C皮肤被碱灼伤时,应先用大量水冲洗 ,并用一定浓度的硼酸溶液淋洗D蒸馏时,为了避免有机溶剂挥发危害人体健康 ,应用塞子堵住尾接管的排气口10关于下列溶液的说法不正确的是(C)A亚硫酸氢钠和碳酸氢钠的中性混合溶液中:c(Na )c(HRO )c(RO )(R 表示“C”或“S”) 3 23B等体积等物质的量浓度的 NaClO(aq)与 NaCl(aq)中离子总数:N 前 c(Cl )c(CH3COOH)D常温下,物质的量浓度相等的 (
9、NH 4)2CO3、(NH 4)2SO4、(NH 4)2Fe(SO4)2 三种溶液中水的电离程度:【解析】A.由物料守恒可知 c(Na )c(HRO )c(RO )c(H 2RO3),故 A 正确;B. 3 23两溶液中 c(Na )相等,NaCl 溶液中 c(H )大于 NaClO 溶液中的 c(H ),由电荷守恒可知NaCl 溶液中离子总数大于 NaClO 溶液中离子总数;C.该中性溶液为CH3COONa、CH 3COOH 和 NaCl 的混合溶液,由溶液呈中性可知水的电离不受影响,即CH3COONa 和 CH3COOH 对水电离造成的影响相互抵消,则 CH3COOH 的量即为所加 HCl
10、的量,故 c(Cl )c(CH 3COOH);D.NH 、CO 都促进水的电离,而且两者相互促进, 4 23NH 、Fe 2 都能促进水的电离。 411香草醛,又名香兰素,是香草豆的香味成分。其常存在于甜菜、香草豆、安息香胶、秘鲁香脂、妥卢香脂等物质中,是一种重要的香料,有浓烈的香气。右图所示为香草醛的结构简式。下列说法中(B)香草醛的分子式为 C8H8O3香草醛可以发生银镜反应香草醛苯环上官能团位置变化带来的异构体还有 10 种在香草醛的溶液中加入碳酸钠溶液,有气泡冒出A一项正确 B两项正确 C三项正确 D四项正确12短周期主族元素 W、X 、Y 、Z 的原子序数依次增大,它们的原子最外层电
11、子数总和等于 Z 的原子序数,由这四种元素组成的一种化合物 M 具有如下性质:下列推断正确的是(D)A原子半径:ZYXW BW 分别与 X、Y 、Z 组成的二元化合物都易溶于水CW、 Y、Z 组成的化合物只含共价键 D最高价氧化物对应的水化物酸性: YX【解析】W、X、Y、Z 四种元素分别为 H、C、N、S,M 为 NH4SCN。13以铬酸钾为原料,用电化学法制备重铬酸钾的实验装置示意图如下所示,其原理为2CrO 2H Cr2O H2O。下列说法不正确的是(C)24 27A电解槽中的离子交换膜是阳离子交换膜B在阴极室,发生的电极反应为 2H2O2e =2OH H 2C该制备过程总反应的化学方程
12、式为2K2CrO43H 2O K2Cr2O72KOH2H 2O 2= = = = =电 解 D电解一段时间后,测定阳极液中 K 和 Cr 的含量,若 K 与 Cr 的物质的量之比为 d,则此时铬酸钾的转化率为(2 d)【解析】由 2CrO 2H Cr2O H 2O 可知,每生成 1 mol Cr2O 需要 2 mol 24 27 27H ,故总反应式应为 4K2CrO44H 2O 2K2Cr2O74KOH 2H 2O 2。= = = = =电 解 二、选择题:本题共 8 小题,每小题 6 分。在每小题给出的四个选项中,第 1418 题只有一项符合题目要求,第 1921 题有多项符合题目要求。全
13、部选对的得 6 分,选对但不全的得 3 分,有选错或不选的得 0 分。14物理学是一门以实验为基础的学科,任何学说和理论的建立都离不开实验。下面给出了几个在物理学发展史上有重要地位的物理实验以及与之相关的物理学发展史实的说法,其中错误的是(B)A 粒子散射实验是原子核式结构理论的实验基础B天然放射现象的发现证实了玻尔原子理论是正确的C光电效应实验表明光具有粒子性D电子的发现揭示了原子不是构成物质的最小微粒15如图所示,某交流发电机的发电原理是矩形线圈在匀强磁场中绕垂直于磁场的轴OO匀速转动。该小型发电机的线圈共 220 匝,线圈面积 S m2,线圈转动的频率为 50 220Hz,线圈内阻不计,
14、磁场的磁感应强度 B T。如果用此发电机带动两个标有“220 V 111 kW”的电动机正常工作,需在发电机的输出端 a、b 与电动机之间接一个理想变压器,电路如图。下列说法不正确的是(A)A发电机的输出电压为 220 V B原副线圈匝数比 n1n2 51C电流表示数为 20 A D发电机的输出功率为 2.2104 W 【解析】线圈转动产生的电动势最大值为:E mNBS 1 100 V,由于线圈内阻不计,2则输出电压就等于电动势,得发电机输出电压的有效值为 1 100 V,故 A 错误;由于电动机的额定电压为 220 V,所以理想变压器输出端的电压也为 220 V,则理想变压器原副线圈匝数比为
15、: ,故 B 正确;由电路可知电源输出功率等于电动机的输入功率,故发电n1n2 U1U2 51机的输出功率为:P 出 2.210 4 W,由理想变压器 P 入 P 出 ,而 P 入 U 1I1,解得 I120 A,故 C、D 正确。16如图甲所示,用粘性材料粘在一起的 A、B 两物块静止于光滑水平面上,两物块的质量分别为 mA1 kg、m B 2 kg,当 A、B 之间产生拉力且大于 0.3 N 时 A、B 将会分离。t0 时刻开始对物块 A 施加一水平推力 F1,同时对物块 B 施加同一方向的拉力 F2,使A、B 从静止开始运动,运动过程中 F1、F 2 方向保持不变 ,F 1、F 2 的大
16、小随时间变化的规律如图乙所示。则下列关于 A、 B 两物块受力及运动情况的分析,正确的是(D)At2.0 s 时刻 A、B 之间作用力为零Bt2.5 s 时刻 A 对 B 的作用力方向向左Ct2.5 s 时刻 A、B 分离D从 t0 时刻到 A、B 分离,它们运动的位移为 5.4 m【解析】由图可知:F 13.60.9t ,F 20.9t ;分析可知一开始 AB 一起运动,(t0 空间内充满方向垂直纸面向里的匀强磁场(其他区域无磁场),磁感应强度为 B,x0.4104 V 时,12 20粒子均不能进入磁场(2 分)当 t0 时刻射入的粒子没有经过加速 ,粒子将以 v02.010 4 m/s 从


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 湖南 师大附中 2019 高考 理科 综合 模拟 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-62957.html