 2019年重庆市中考第一轮基础知识《第9讲:物质的组成和结构》同步练习(含答案)
2019年重庆市中考第一轮基础知识《第9讲:物质的组成和结构》同步练习(含答案)
《2019年重庆市中考第一轮基础知识《第9讲:物质的组成和结构》同步练习(含答案)》由会员分享,可在线阅读,更多相关《2019年重庆市中考第一轮基础知识《第9讲:物质的组成和结构》同步练习(含答案)(6页珍藏版)》请在七七文库上搜索。
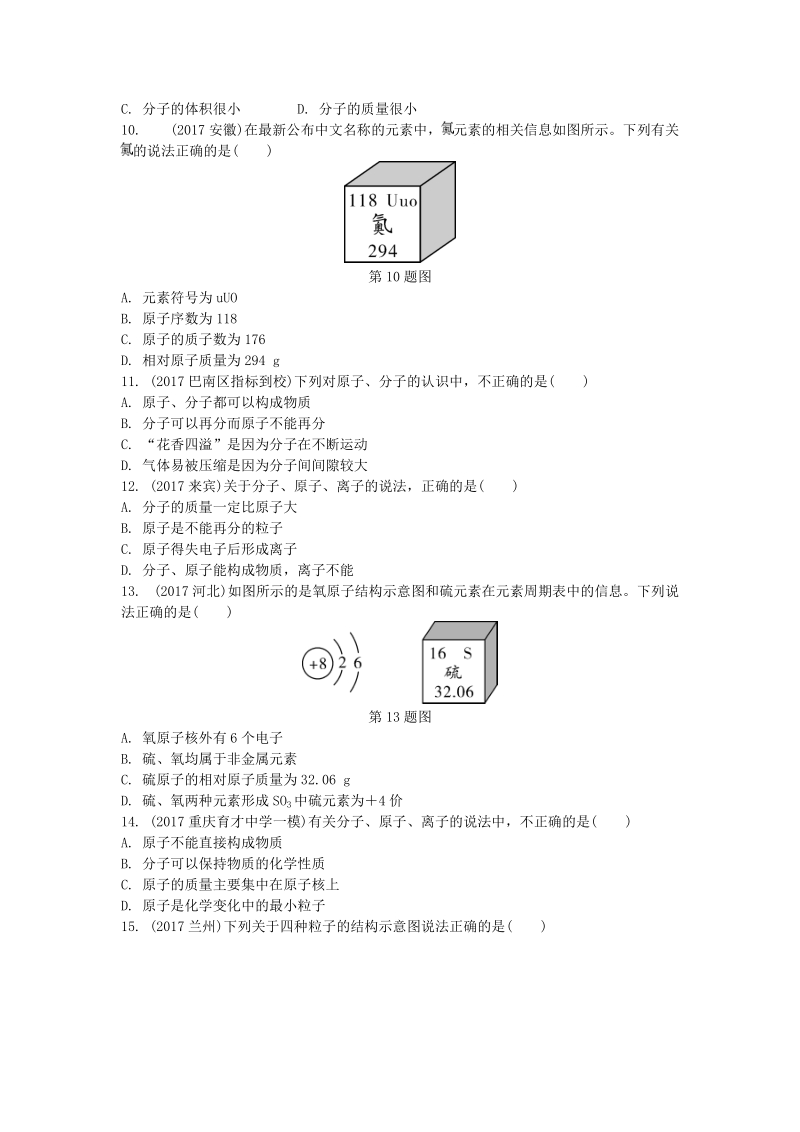
1、第 9讲 物质的组成和结构(时间:30 分钟 分值:47 分)一、选择题1. (2017苏州)下列元素名称与元素符号书写都正确的是( )A. 锌 Zn B. 硅 SI C. 氯 cl D. 贡 Hg2. (2017北京)“含氟牙膏”中的“氟”指的是( )A. 分子 B. 原子 C. 离子 D. 元素 3. (2017常州)下列物质的组成元素相同的是( )A. 干冰和冰B. 纯碱和烧碱C. 金刚石和石墨D. 生石灰和熟石灰4. (2017重庆巴蜀中学下学期一模)下列各组物质中,都由离子构成的一组是( )A. NaCl、CuSO 4 B. CH4、HClC. Si、CO 2 D. Ar、Au5.
2、(2017玉林)不同元素最本质的区别是( )A. 质子数不同B. 核外电子数不同C. 中子数不同D. 相对原子质量不同6. (2017上海)二氧化碳气体转化为干冰的过程中发生改变的是( )A. 分子种类 B. 分子间距C. 原子大小 D. 原子种类7. (2018原创)下列粒子结构示意图中,表示原子的是( )8. (2017山西)小美从某粒子结构示意图(如图)中,获取了下列信息,其中错误的是( )第 8题图A. 它有两个电子层 B. 它的核电荷数为 12C. 它表示阴离子 D. 它表示相对稳定结构 9. (2017大渡口区二模)从分子和原子的角度看,造成非吸烟者在公共场所吸“二手烟”的主要原因
3、是( )A. 分子在不断运动 B. 分子之间有间隙C. 分子的体积很小 D. 分子的质量很小10. (2017安徽)在最新公布中文名称的元素中, 元素的相关信息如图所示。下列有关的说法正确的是( )第 10题图A. 元素符号为 uUOB. 原子序数为 118C. 原子的质子数为 176D. 相对原子质量为 294 g11. (2017巴南区指标到校)下列对原子、分子的认识中,不正确的是( )A. 原子、分子都可以构成物质B. 分子可以再分而原子不能再分C. “花香四溢”是因为分子在不断运动D. 气体易被压缩是因为分子间间隙较大12. (2017来宾)关于分子、原子、离子的说法,正确的是( )A
4、. 分子的质量一定比原子大B. 原子是不能再分的粒子C. 原子得失电子后形成离子D. 分子、原子能构成物质,离子不能13. (2017河北)如图所示的是氧原子结构示意图和硫元素在元素周期表中的信息。下列说法正确的是( )第 13题图A. 氧原子核外有 6个电子B. 硫、氧均属于非金属元素C. 硫原子的相对原子质量为 32.06 gD. 硫、氧两种元素形成 SO3中硫元素为4 价14. (2017重庆育才中学一模)有关分子、原子、离子的说法中,不正确的是( )A. 原子不能直接构成物质B. 分子可以保持物质的化学性质C. 原子的质量主要集中在原子核上D. 原子是化学变化中的最小粒子15. (20
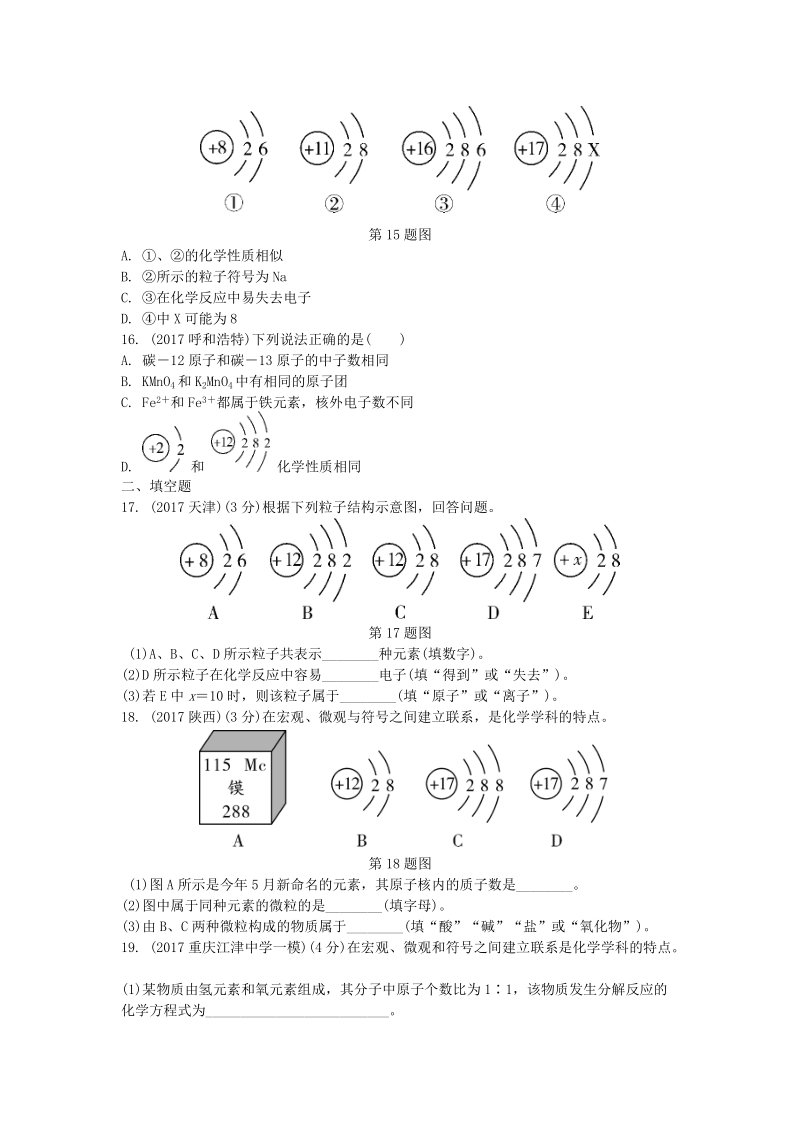
5、17兰州)下列关于四种粒子的结构示意图说法正确的是( )第 15题图A. 、的化学性质相似B. 所示的粒子符号为 NaC. 在化学反应中易失去电子D. 中 X可能为 816. (2017呼和浩特)下列说法正确的是( )A. 碳12 原子和碳13 原子的中子数相同B. KMnO4和 K2MnO4中有相同的原子团C. Fe2 和 Fe3 都属于铁元素,核外电子数不同D. 和 化学性质相同二、填空题17. (2017天津)(3 分)根据下列粒子结构示意图,回答问题。第 17题图(1)A、B、C、D 所示粒子共表示_种元素(填数字)。(2)D所示粒子在化学反应中容易_电子(填“得到”或“失去”)。(3
6、)若 E中 x10 时,则该粒子属于_(填“原子”或“离子”)。 18. (2017陕西)(3 分)在宏观、微观与符号之间建立联系,是化学学科的特点。第 18题图(1)图 A所示是今年 5月新命名的元素,其原子核内的质子数是_。(2)图中属于同种元素的微粒的是_(填字母)。(3)由 B、C 两种微粒构成的物质属于_(填“酸”“碱”“盐”或“氧化物”)。19. (2017重庆江津中学一模)(4 分)在宏观、微观和符号之间建立联系是化学学科的特点。(1)某物质由氢元素和氧元素组成,其分子中原子个数比为 11,该物质发生分解反应的化学方程式为_。(2)根据常见元素和原子团的化合价,下列四种物质的化学
7、式书写不正确的是_。A. 氧化钠 Na2O B. 氧化铝 AlOC. 硫酸钠 Na2SO4 D. 氯化铁 FeCl2(3)镁、钠、铝三种金属的活动性由弱到强的顺序是_,请写出铝离子的离子结构示意图_。20. (2017泰安)(5 分)下表是元素周期表中第 2、3 周期的元素,请回答有关问题。(1)下列各组具有相似化学性质的元素是_(填字母序号)。A. Na、Cl B. O、S C. F、Cl D. Cl、Ar(2)写出一条第三周期元素原子的核外电子排布规律_。(3)第 7号元素与第 12号元素的原子形成化合物的化学式为_。(4)某粒子的结构示意图为 ,当 x y8 时,该粒子的符号为_。(5)

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2019 重庆市 中考 第一轮 基础知识 物质 组成 结构 同步 练习 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-62723.html