 2019年贵州省毕节市中考化学一模试卷(含答案解析)
2019年贵州省毕节市中考化学一模试卷(含答案解析)
《2019年贵州省毕节市中考化学一模试卷(含答案解析)》由会员分享,可在线阅读,更多相关《2019年贵州省毕节市中考化学一模试卷(含答案解析)(15页珍藏版)》请在七七文库上搜索。
1、2019 年贵州省毕节市中考化学一模试卷一、选择题(本题包括 8 小题,毎小题 3 分,共 24 分每題只有一个选项符合题意,请把该项序号按要求在答题卡上相应的位置填涂)1在自然科学领域,对于“物质”概念的认识中,正确的是( )A物质不灭理论说明物质不会转化B物质用肉眼都能看的见,但构成物质的微粒,用肉眼都是看不见的C物质是可变的,但物体在静止状态下,构成物质的微粒是不会发生变化的D物质都是由肉眼看不见的微粒按一定规律构成的2为了确定某化肥的种类,下列探究过程发生了化学变化的是( )A观察其外观,为白色晶体B闻其气味,无明显气味C测其溶解性,可溶于水D加熟石灰研磨,有刺激性气味3下列反应不属于
2、化学反应基本类型的是( )ANH 4HCO3 NH3+CO 2+H 2OBCaCO 3+CO2+H2OCa(HCO 3) 2C2NaCl+2H 2O 2NaOH+H2+Cl 2D2Mg+CO 2 2MgO+C4“花气袭人知骤暖,鹊声穿树喜新晴”描述了春天晴暖、鸟语花香的山村美景。下列从微观角度对“花气袭人知骤暖”的解释最合理的是( )A微粒的体积小、质量轻B微粒间有空隙C微粒在不断运动D温度越高,微粒运动越快5下列物质由原子构成的是( )A蒸馏水 B氯化钠 C金刚石 DC 606除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )选项 物质(括号内为杂质) 试剂 操作方法A HCl
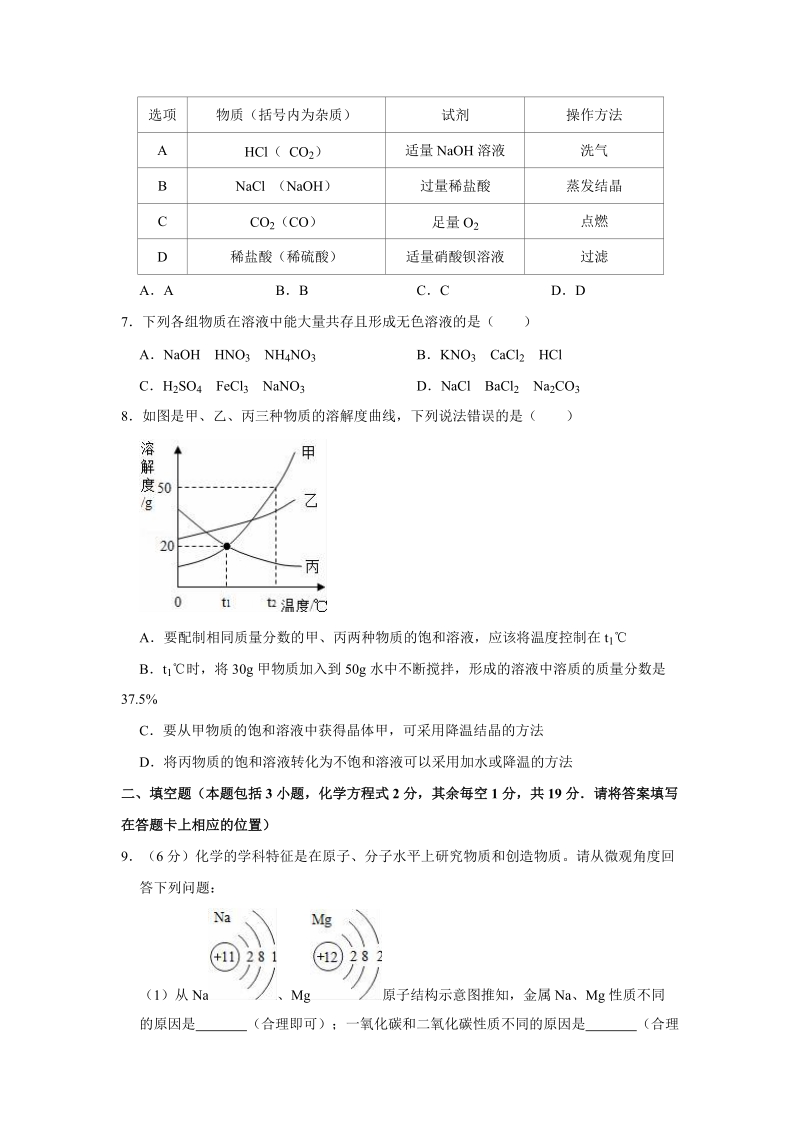
3、( CO2) 适量 NaOH 溶液 洗气B NaCl (NaOH ) 过量稀盐酸 蒸发结晶C CO2(CO) 足量 O2 点燃D 稀盐酸(稀硫酸) 适量硝酸钡溶液 过滤AA BB CC DD7下列各组物质在溶液中能大量共存且形成无色溶液的是( )ANaOH HNO3 NH4NO3 BKNO 3 CaCl2 HClCH 2SO4 FeCl3 NaNO3 DNaCl BaCl2 Na2CO38如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是( )A要配制相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制在 t1Bt 1时,将 30g 甲物质加入到 50g 水中不断搅拌,形成的溶液中溶质的
4、质量分数是37.5%C要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法D将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法二、填空题(本题包括 3 小题,化学方程式 2 分,其余毎空 1 分,共 19 分请将答案填写在答题卡上相应的位置)9(6 分)化学的学科特征是在原子、分子水平上研究物质和创造物质。请从微观角度回答下列问题:(1)从 Na 、Mg 原子结构示意图推知,金属 Na、Mg 性质不同的原因是 (合理即可);一氧化碳和二氧化碳性质不同的原因是 (合理即可);NaOH 溶液和 Ca(OH) 2 溶液都能使酚酞变红的原因是 。(2)图 1 反应的化学方程式为 ,该反应过程
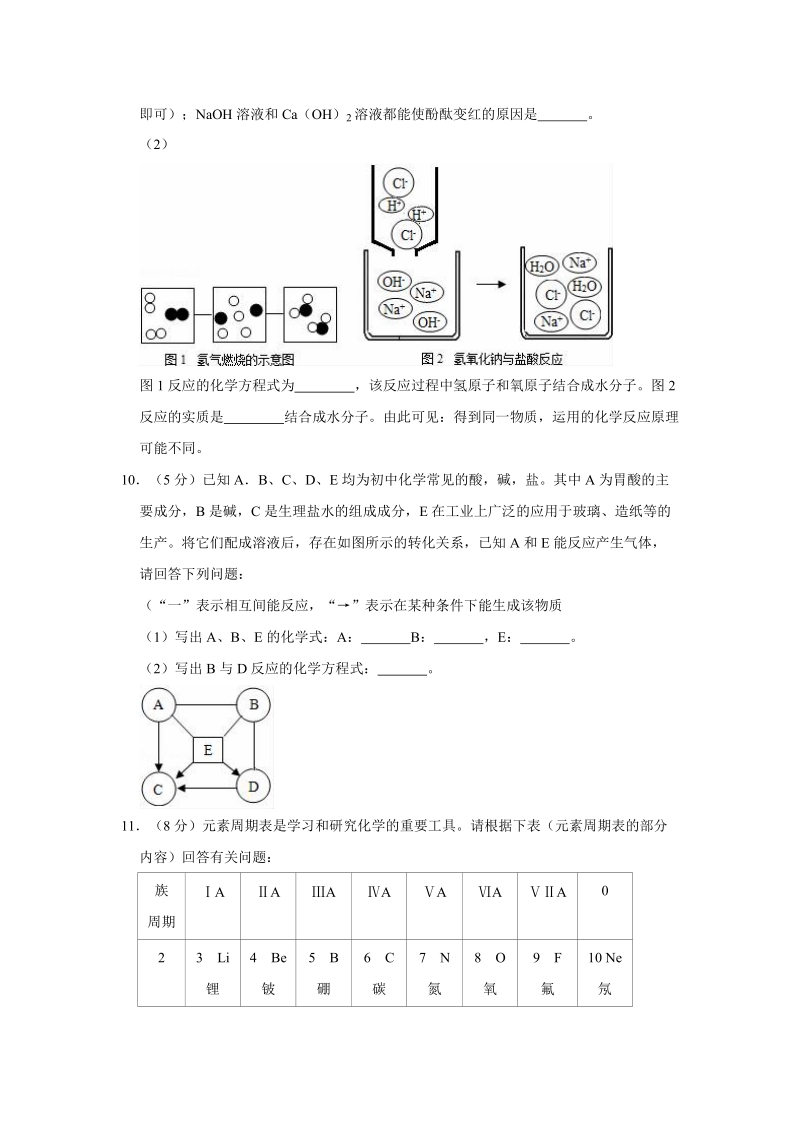
5、中氢原子和氧原子结合成水分子。图 2反应的实质是 结合成水分子。由此可见:得到同一物质,运用的化学反应原理可能不同。10(5 分)已知 AB、C、 D、E 均为初中化学常见的酸,碱,盐。其中 A 为胃酸的主要成分,B 是碱,C 是生理盐水的组成成分, E 在工业上广泛的应用于玻璃、造纸等的生产。将它们配成溶液后,存在如图所示的转化关系,已知 A 和 E 能反应产生气体,请回答下列问题:(“一”表示相互间能反应,“”表示在某种条件下能生成该物质(1)写出 A、B、E 的化学式:A : B: ,E: 。(2)写出 B 与 D 反应的化学方程式: 。11(8 分)元素周期表是学习和研究化学的重要工具
6、。请根据下表(元素周期表的部分内容)回答有关问题:族周期A A A A A A A 0 2 3 Li锂4 Be铍5 B硼6 C碳7 N氮8 O氧9 F氟10 Ne氖6.941 9.012 10.81 12.01 14.01 16.00 19.00 20.183 11 Na钠22.9912 Mg镁24.3113 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.95(1)请从上表中查出关于硼元素的一条信息: 。(2)第 3 周期(横行)中属于金属元素的是 (填一种),其阳离子是 。(3)第 11 号元素与第 17 号元素组成的化
7、合物是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。aC 和 Ne bBe 和 Mg cAl 和 Si dF 和 Cl(5)第 9 号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO 2)发生反应,生成四氟化硅气体(SiF 4)和水,该反应的化学方程式为 。三、实验题(本题包括 2 小题,每空 1 分,共 11 分请将答案填写在答题卡上相应的位置)12(7 分)下列装置常用于实验室制取气体。根据给出的装
8、置回答下列问题。(1)指出编号仪器名称: 。(2)实验室利用 A 装置制取氧气,反应原理用化学方程式表示为 。(3)制取并收集二氧化碳应选择的装置是 (从 AE 中选择),使用该套装置制取气体的突出优点是 ,该反应原理用化学方程式表示为 改用 F 装置收集二氧化碳,则气体应从 端进入。制得的二氧化碳中常含有少量的氯化氢气体与水蒸气,欲使个 G、H 装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体 (用端口字母表示)。(4)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶一段时间后,测得该装置中溶液的 pH 7(填“” 、“”或“”)13(4 分)化学实验是科学探究的重要途径。请根据下列实验图
9、示回答相关问题:A 实验中,烧杯的作用是 。B 实验中,硬质玻璃管中的现象是 。C 实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 (填序号),步骤 中玻璃棒的作用是 ;若按照 的步骤配制 50g16%的氯化钠溶液,所配制溶液的溶质质量分数 (填“偏小”或“偏大”)。四、计算题(本题包含 2 小题,其中 14 小题 4 分,15 小题 4 分,共 8 分请将答案和解题过程写在答题卡上相应位置,第 14、15 小题要求写出解题过程14“塑化剂”是一种工业原料,但不法商人把它添加到饮用品当中,人喝了这样的饮用品,会对身体造成严重的危害。已知“塑化剂”的主要成分是邻苯二甲酸二辛酯,化学式为 C
10、24H38O4,完成下列问题:(1)邻苯二甲酸二辛酯的相对分子质量是 。(2)邻苯二甲酸二辛酯中碳、氢、氧三种元素的质量比是 。(3)邻苯二甲酸二辛酯中碳元素的质量分数是 。(精确到 0.1%)(4)390 克邻苯二甲酸二辛酯中碳元素的质量是 。15(4 分)将一定量的石灰石放入烧杯中,加入一定量的稀盐酸,恰好完全反应,产生4.4g 气体,反应后所得溶液的溶质的质量分数为 20%(杂质不溶于水,也不参与反应)计算:反应前稀盐酸的溶质的质量分数。(结果精确到 0.1%)2019 年贵州省毕节市中考化学一模试卷参考答案与试题解析一、选择题(本题包括 8 小题,毎小题 3 分,共 24 分每題只有一
11、个选项符合题意,请把该项序号按要求在答题卡上相应的位置填涂)1【分析】A、根据物质不灭理论说明物质会转化进行解答;B、根据气体物质就看不见、摸不着进行解答;C、根据构成物质的微粒的性质进行解答;D、根据物质都是由微观粒子离子、分子、原子等微粒构成进行解答。【解答】解:A、物质不灭理论说明物质会转化,故 A 错误;B、气体物质就看不见、摸不着,故 B 错误;C、构成物质的微粒在不断的运动,物体在静止状态下,构成物质的微粒也会发生变化的,故 C 错误;D、物质都是由微观粒子离子、分子、原子等微粒构成,它们极其微小肉眼看不见,且按一定规律构成,故 D 正确。故选:D。【点评】本题主要考查了“物质”的
12、涵义和微粒性;了解一些常用物质的分类和性质及其应用。2【分析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化。物质的化学性质是指在化学变化中表现出来的性质,如可燃性、稳定性;物质的物理性质是指不需要通过化学变化表现出来的性质,如颜色、状态、味道、溶解性等;性质和变化,性质是特性,变化是过程,描述性质一般用“能、易、难、会、可以”等。【解答】解:A、观察其外观,为白色晶体,描述的是颜色、状态,不需要通过化学变化表现出来的性质,属于物理性质。B、闻其气味,无明显气味,描述的气味,不需要通过化学变化表现出来的性质,属于物理性质。C、测其溶解性,可溶于水,描述的溶解性,不需要通过化学
13、变化表现出来的性质,属于物理性质。D、加熟石灰研磨产生刺激性气味的过程中有新物质氨气等生成,属于化学变化。故选:D。【点评】本题难度不大,解答时要分析变化过程中是否有新物质生成,这里的新物质是指和变化前的物质是不同种的物质,若有新物质生成属于化学变化;充分理解两种变化和两种性质的概念与区别是正确解题的关键。3【分析】化合反应,两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;分解反应,一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”。置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;复分解反应是两种化合物相互交换成分生成两种新的化合物的反
14、应。【解答】解:A、属于分解反应,属于基本反应类型,故 A 错;B、属于化合反应,属于基本反应类型,故 B 错;C、不属于化学反应基本类型,故 C 正确;D、属于置换反应,属于基本反应类型,故 D 错。故选:C。【点评】抓住四种反应的特点,根据反应前后物质种类数“多变一”还是“一变多”对所发生的反应进行类型判断。4【分析】根据花气袭人说明分子在不断的运动,知骤暖说明气温升高,分子运动加快进行解答。【解答】解:花气袭人说明分子在不断的运动,知骤暖说明气温升高,分子运动加快,所以“花气袭人知骤暖”的解释最合理的是温度越高,微粒运动越快。故选:D。【点评】本题难度不大,会利用分子的基本性质分析和解决
15、问题的方法是正确解答此类题的关键。5【分析】根据金属和大多数固态非金属单质等由原子构成,有些物质是由分子构成的,如水、气态非金属单质等,有些物质是由离子构成的,如氯化钠,进行分析判断即可。【解答】解:A、蒸馏水是由水分子构成的,故选项错误。B、氯化钠是由钠离子和氯离子构成的,故选项错误。C、金刚石属于固态非金属单质,是由碳原子直接构成的,故选项正确。D、C 60 是由 C60 分子构成的,故选项错误。故选:C。【点评】本题难度不大,主要考查了构成物质的微观粒子方面的知识,掌握常见物质的粒子构成是正确解答本题的关键。6【分析】A、根据酸性气体会与碱反应进行分析;B、根据盐酸会与氢氧化钠生成氯化钠
16、进行分析;C、根据一氧化碳具有可燃性进行分析;D、根据硫酸和硝酸钡生成硝酸进行分析。【解答】解:A、HCl 和二氧化碳都会与氢氧化钠反应,在除去杂质的同时也会除去主要物质,故 A 错误;B、过量的盐酸和氢氧化钠会生成氯化钠,氯化氢具有挥发性,剩余的盐酸在蒸发结晶挥发出去,后就只剩氯化钠固体,故 B 正确;C、一氧化碳是少量的,和二氧化碳均匀的混合在一起的,不能被点燃,故 C 错误;D、硫酸和硝酸钡会生成硫酸钡沉淀和硝酸,生成的硝酸对于盐酸也是杂质,故 D 错误。故选:B。【点评】在解此类题时,首先分析杂质和物质的性质,然后选择适当的试剂只与杂质反应,不与主要物质反应,不会生成新的杂质。7【分析

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2019 贵州省 毕节市 中考 化学 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 贵州毕节
- 贵州省毕节市织高三第一次联考
- 毕节市中考真题
- 毕节市民族中学原 毕节地区民族中学
- 2021年毕节市中考摸拟试卷(七)
- 2021年毕节市中考模拟试卷
- 2021年毕节市中考模拟试卷(八)
- 毕节市2021中考数学模拟卷10
- 贵州省毕节市2021年中考卷
- 毕节试卷
- 2021年贵州省毕节市中考数学一模试卷含答案解析
- 2018年贵州省毕节市中考化学试卷含详细答案
- 2019年贵州省毕节市中考化学试卷含详细答案
- 2019年贵州省毕节市中考数学试卷含答案解析
- 2020年贵州省毕节市中考语文模拟试卷一含答案
- 2020年贵州省毕节市中考化学试卷含答案解析
- 2019年贵州省毕节市中考数学模拟试卷二含答案解析
- 2019年贵州省毕节市中考化学一模试卷含答案解析



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-61728.html