 2018年中考化学真题分类汇编解析:创新题
2018年中考化学真题分类汇编解析:创新题
《2018年中考化学真题分类汇编解析:创新题》由会员分享,可在线阅读,更多相关《2018年中考化学真题分类汇编解析:创新题(8页珍藏版)》请在七七文库上搜索。
1、专题分类:创新题1.(2018 吉林)请完成下列思维导图。【答案】(1)硅铝铁;金属的化学性质:活泼金属与酸反应生成盐和氢气,金属与氧气反应生成金属氧化物,不能生成盐。故选 A。3.(2018 重庆 B)小明笔记中有处错误你认为是图中的哪一处()A.a处 B.b 处 C.e 处 D.d 处【答案】B【解析】赤铁矿的主要成分是氧化铁(Fe 2O3) ;用一氧化碳在高温下与氧化铁,利用了一氧化碳还原性把铁从氧化铁中还原出来,一氧化碳发生了氧化反应,氧化铁发生了还原反应;该反应不属于置换反应。故选 B。4.(2018 南京)如图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。下列说法正确的是
2、()A在 a、b、c 三种曲线所示的实验中,所用盐酸浓度越大,V 时所得溶液的 pH越大B在 a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色C在 a、b、c 三种曲线所示的实验中,反应速率相同D在 a、b、c 三种曲线所示的实验中,溶液酸性由强到弱的顺序是 abc解析:A、由图可以看出是向盐酸中加入氢氧化钠溶液,在 a、b、c 三种曲线所示的实验中,恰好完全反应,即 pH=7时,需要氢氧化钠溶液体积相等,因此所用盐酸浓度越大,需要加入的氢氧化钠溶液浓度也越大,V 时氢氧化钠溶液过量,所得溶液的 pH越大,该选项说法正确;B、是向盐酸中加入氢氧化钠溶液,在 a曲线所示的实验中,若用
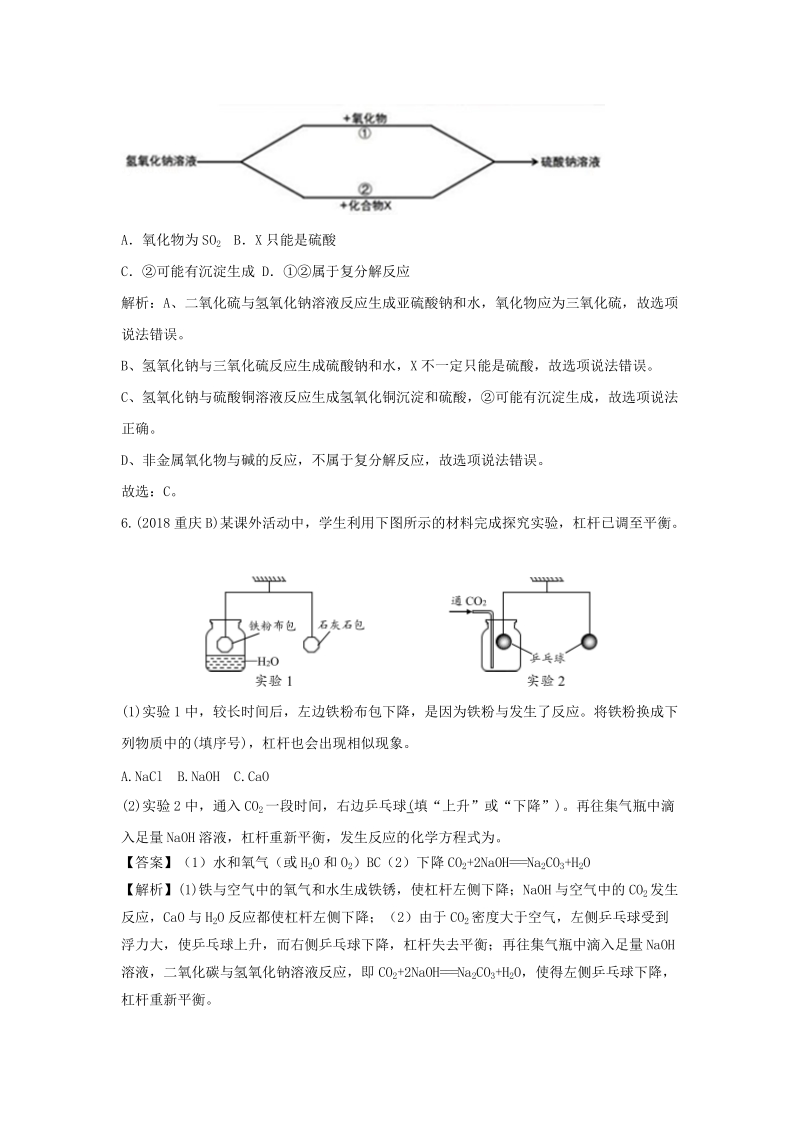
3、酚酞做指示剂,酚酞溶液由无色变为红色,该选项说法不正确;C、在 a、b、c 三种曲线所示的实验中,由于反应物浓度不同,反应速率不相同,该选项说法不正确;D、在 a、b、c 三种曲线所示的实验中,随着加入氢氧化钠溶液的多少,溶液分别显酸性、显中性、显碱性,该选项说法不正确。故选:A。5.(2018 成都)如图物质经一步反应转化的两种途径,相关说法正确的是()A氧化物为 SO2 BX 只能是硫酸C可能有沉淀生成 D属于复分解反应解析:A、二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,氧化物应为三氧化硫,故选项说法错误。B、氢氧化钠与三氧化硫反应生成硫酸钠和水,X 不一定只能是硫酸,故选项说法错误。C
4、、氢氧化钠与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸,可能有沉淀生成,故选项说法正确。D、非金属氧化物与碱的反应,不属于复分解反应,故选项说法错误。故选:C。6.(2018重庆 B)某课外活动中,学生利用下图所示的材料完成探究实验,杠杆已调至平衡。(1)实验 1中,较长时间后,左边铁粉布包下降,是因为铁粉与发生了反应。将铁粉换成下列物质中的(填序号),杠杆也会出现相似现象。A.NaCl B.NaOH C.CaO(2)实验 2中,通入 CO2一段时间,右边乒乓球(填“上升”或“下降”)。再往集气瓶中滴入足量 NaOH溶液,杠杆重新平衡,发生反应的化学方程式为。【答案】(1)水和氧气(或 H2O和 O
5、2)BC(2)下降 CO2+2NaOH=Na2CO3+H2O【解析】(1)铁与空气中的氧气和水生成铁锈,使杠杆左侧下降;NaOH 与空气中的 CO2发生反应,CaO 与 H2O反应都使杠杆左侧下降;(2)由于 CO2密度大于空气,左侧乒乓球受到浮力大,使乒乓球上升,而右侧乒乓球下降,杠杆失去平衡;再往集气瓶中滴入足量 NaOH溶液,二氧化碳与氢氧化钠溶液反应,即 CO2+2NaOH=Na2CO3+H2O,使得左侧乒乓球下降,杠杆重新平衡。7.(2018 黄冈)对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究 CO2通入 NaOH溶液是否发生了反应,设计了下列二组实验。请和化学兴趣小
6、组的同学一起探究并回答问题:【设计与实验】实验序号实验步骤一 实验步骤二实验序号实验步骤一 实验步骤二实验 I 实验 II【探究与结论】(1)实验 I中步骤一看不到明显现象,步骤二产生的现象是_。 (2)实验中步骤二看到有白色沉淀析出,则发生反应的化学方程式是_。(3)在实验的步骤一中 CO2和 NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是_。【拓展延伸】现有下列信息:资料卡片一20NaOH、Na 2CO3在水中的溶解度物质溶解度(S)/gNaOH109Na2CO321.8资料卡片二20NaOH、Na 2CO3在乙醇中的溶解度物质溶解度(S)/gNaOH17.3Na2CO30.
7、01请你和化学兴趣小组的同学一起利用以上料信息再设计实验,证明 CO2确实与 NaOH发生了化学反应。实验的操作为:_。看到的现象是_。【答案】(1).有气泡冒出(2).CaCl 2Na 2CO3=CaCO32NaCl(3).CO 2与 NaOH溶液反应生成易溶于水的 Na2CO3(4).将二氧化碳通入盛有一定体积的饱和 NaOH乙醇溶液试管中(5).有白色沉淀产生【解析】(1)盐酸和碳酸钠反应会生成二氧化碳和水、氯化钠,所以实验 I中步骤一的溶液中加入稀盐酸,观察到气泡产生现象;(2)实验步骤二中加入的氯化钙溶液和碳酸钠反应生成碳酸钙沉淀和氯化钠,反应的化学方程式是:CaCl 2Na 2CO


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2018 年中 化学 分类 汇编 解析 创新
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 中考书法题
- 2018年中考语文真题分类汇编创新题含答案
- 2018年中考化学真题分类汇编解析溶液
- 2018年中考化学真题分类汇编解析物质的推断2
- 2018中考物理分类汇编解析作图题分类
- 2018年中考化学真题分类汇编解析盐化肥
- 2018年中考化学真题分类汇编解析化学用语
- 2018年中考化学真题分类汇编解析常见气体的制取
- 2018年中考化学真题分类汇编解析工艺流程1
- 2018年中考化学真题分类汇编解析工艺流程2
- 2018年中考化学真题分类汇编解析科学探究
- 2018年中考化学真题分类汇编解析创新题
- 2018年中考化学真题分类汇编解析酸和碱
- 2018年中考化学真题分类汇编解析化学与环境一
- 2018年中考化学真题分类汇编解析材料阅读类
- 2018年中考化学真题分类汇编解析化学与生活
- 2018年中考化学真题分类汇编解析物质的推断1
- 2021中考真题
- 面试真题
- 2022中考真题



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-58945.html