 鲁科版高中化学必修2《第2章第3节 化学反应的利用(第2课时)》课件(共37张)
鲁科版高中化学必修2《第2章第3节 化学反应的利用(第2课时)》课件(共37张)
《鲁科版高中化学必修2《第2章第3节 化学反应的利用(第2课时)》课件(共37张)》由会员分享,可在线阅读,更多相关《鲁科版高中化学必修2《第2章第3节 化学反应的利用(第2课时)》课件(共37张)(37页珍藏版)》请在七七文库上搜索。
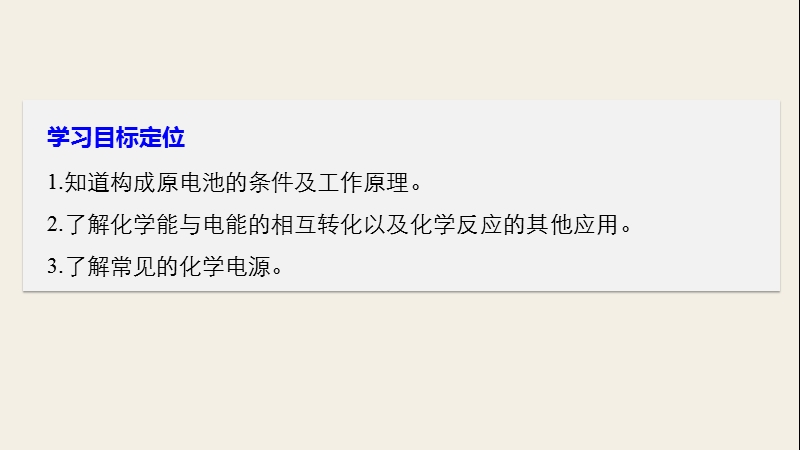
1、第2课时 化学反应为人类提供能量,第2章 第3节 化学反应的利用,学习目标定位 1.知道构成原电池的条件及工作原理。 2.了解化学能与电能的相互转化以及化学反应的其他应用。 3.了解常见的化学电源。,内容索引,新知导学 新知探究 点点落实,达标检测 当堂检测 巩固反馈,新知导学,1.下图为“即热饭盒”的结构示意图。这种饭盒使用起来非常方便,撤去底部的隔板几分钟后,饭菜就变热了,试从能量转化的角度说明其中的原理。,一、化学反应为人类提供能量,答案 当撤去隔板后,镁粉、铁粉和水相互接触,镁与水发生化学反应的方程式为Mg2H2O=Mg(OH)2H2,食物被反应放出的能量加热后变成热的食物。,答案,2
2、.铁路工人经常利用铝热剂来焊接钢轨,你能解释其中的原理吗?,答案,答案 氧化铁粉末和铝粉的混合物是常用的铝热剂。使用时先点燃镁条,镁条剧烈燃烧,放出大量的热,使三氧化二铁粉末和铝粉在较高温度下发生剧烈反应,生成氧化铝和铁单质,并放出大量的热,反应的化学方程式为Fe2O32Al Al2O32Fe。高温下铁呈液态,可焊接断裂的钢轨。,3.火力发电原理:首先通过化石燃料燃烧,使 能转变为 能;加热水使之汽化为蒸气以推动蒸汽轮机, 转化为机械能;然后带动发电机发电,机械能转化为 。 4.化工生产中通过电解 来制备烧碱、氢气和氯气,利用 能向 能的转化;物质燃烧发光是 能转化为 能;植物的光合作用是 能
3、转化为 能。,化学,热,热能,电能,饱和食盐水,电,化学,化学,光,光,化学,1.下列关于能量转换的认识中不正确的是 A.电解水生成氢气和氧气时,电能转化为化学能 B.绿色植物进行光合作用时,太阳能转化为化学能 C.煤燃烧时,化学能主要转化为热能 D.白炽灯工作时,电能全部转化为光能,答案,解析,易错警示,解析 白炽灯工作时,电能没有全部转化为光能,还转化为热能等。,易错警示 化学反应过程中常常伴有化学能转化为多种形式的能。,1.按要求完成下列实验,并填表:,二、化学能转化为电能,锌片逐渐溶解,表面有气泡;铜片表面无气泡,锌与稀硫酸发生置换反应产生H2,而铜则不能,锌片逐渐溶解,铜片表面有气泡
4、,检流计指针发生偏转,导线中有电流,化学反应中化学能转化为电能,两锌片逐渐溶解且表面都有气泡,检流计指针不偏转,锌与稀硫酸反应,导线中无电流,无现象,乙醇是非电解质,导线中无电流,2.原电池 (1)原电池是利用 反应,将 能转化为 能的装置。 (2)原电池的构成条件 自发的 反应均可设计成原电池; 具有 的两个电极(金属与金属或金属与非金属导体); 两电极均插入 溶液中; 两极用导线连成闭合回路。,氧化还原,化学,电,氧化还原,活动性不同,电解质,(3)原电池的工作原理 根据原电池反应原理,分析下图并填空:,原电池总反应式:_。 能量转化过程:原电池在工作时, 极失去电子,电子通过导线流向 _
5、极,溶液中氧化性物质 此电子,发生 反应,在闭合回路中形成电流, 能转化为 能。,Zn2H=Zn2H2,负,正,得到,还原,化学,电,相关视频,负极,2H+2e-=H2 ,氧化反应,Zn-2e-=Zn2+,正极,还原反应,还原性较弱的金属或能导电的非金属,还原 反应,氧化 反应,电子流入,电流 流出,还原性较强的金属,电子 流出,电流 流入,关键提醒 (1)可以从多个角度判断原电池的正极和负极。 (2)电子只能在导体中定向移动,不能通过溶液。,2.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 两烧杯中铜片表面均无气泡产生 甲中铜片是正极,乙中铜片是负极 两烧杯中溶液
6、的c(H)均减小 产生气泡的速率甲比乙慢 甲中 向Zn片移动,H向Cu片移动 乙中电流从Cu片流向Zn片 甲乙两烧杯中Cu片的质量均不变 A. B. C. D.,答案,解析,规律总结,解析 装置甲构成CuZn原电池,装置乙未形成闭合回路,不能构成原电池,只发生Zn与稀H2SO4的反应,不能产生电流。甲中Zn为负极,Cu为正极,H向正极移动,在Cu片表面得电子被还原为H2逸出, 向负极移动。甲、乙两烧杯中都发生反应:Zn2H=Zn2H2,故c(H)减小,铜片均不发生反应,故铜片质量不变。,规律总结,规律总结 形成原电池可以加快化学反应。如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 鲁科版 高中化学 必修 化学反应 利用 课时 课件 37
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-54614.html