 江苏省徐州市2019年中考化学复习《第6章溶解现象13物质的溶解性》课时训练(含答案)
江苏省徐州市2019年中考化学复习《第6章溶解现象13物质的溶解性》课时训练(含答案)
《江苏省徐州市2019年中考化学复习《第6章溶解现象13物质的溶解性》课时训练(含答案)》由会员分享,可在线阅读,更多相关《江苏省徐州市2019年中考化学复习《第6章溶解现象13物质的溶解性》课时训练(含答案)(4页珍藏版)》请在七七文库上搜索。
1、课时训练(十三) 物质的溶解性(建议限时:30 分钟)|夯实基础|1.2018南京 在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是 ( )A.称取粗盐后,把粗盐研磨细B.溶解时搅拌,加速粗盐溶解C.称量精盐前,把精盐固体转移到纸上D.蒸发时搅拌,防止因局部温度过高,造成液滴飞溅2.2018福建 某同学模拟闽籍化学家侯德榜的 “侯氏制碱法 ”制纯碱,需用 50.0 g水配制 20 的 NaCl饱和溶液(20 时 NaCl的溶解度为 36.0 g),应称取 NaCl的质量为 ( )A.18.0 g B.16.0 gC.13.2 g D.11.5 g3.室温时,有两瓶硝酸钾溶液,一瓶为饱
2、和溶液(溶质的质量分数为 24%),另一瓶为 5%的溶液,下列实验操作中,无法区分这两种溶液的是 ( )A.加一定量的水B.加入少量硝酸钾晶体C.略降低温度D.室温时,蒸发少量水4.将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法,其中可行的是 ( )加入 CaO 加入 Ca(OH)2升高温度 降低温度A. B.C. D.5.2018金华 20 时,在各盛有 100 g水的烧杯中,分别加入 10 g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图 Z13-1。下列说法正确的是 ( )图 Z13-1A.所得溶液可能都是饱和溶液B.20 时,乙溶液的溶质质量最小C.溶液的
3、溶质质量分数:甲丙乙D.升高温度,溶液的溶质质量分数一定变大6.如图 Z13-2是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是 ( )A.t1时,乙、丙两种物质的溶液中溶质质量分数一定相等B.将 t2时甲、乙、丙的饱和溶液分别升温至 t3,所得溶液的溶质质量分数由大到小的顺序是乙甲丙C.t4时,将等质量的甲、乙、丙三种固体分别配制成饱和溶液,需加水质量最多的是甲D.甲中混有少量乙时,应采用蒸发结晶的方法提纯甲图 Z13-2图 Z13-37.2018邵阳 在粗盐的提纯实验中:(1)其主要操作步骤顺序是 。 过滤 溶解 蒸发 计算产率(2)图 Z13-3是某同学过滤的操作图
4、,指出图中明显错误是 ;过滤后,如果滤液仍然浑浊,其原因可能是 (填一种)。 (3)蒸发时,蒸发皿内出现 时应停止加热。 8.2018益阳 下表是 NaCl、NH 4Cl 在不同温度时的溶解度。温度/ 0 20 40 60 80NaCl 35.7 36.0 36.6 37.3 38.4溶解度/gNH4Cl 29.4 37.2 45.8 55.2 65.6(1)以上两种物质的溶解度受温度影响较大的是 。 (2)40 时,将 40.6 g NaCl 加入到 100 g 水中,充分搅拌使之溶解,所得溶液的质量为 g。 (3)20 时,NaCl 饱和溶液的溶质质量分数为 (精确到 0.1%)。 |能力
5、提升|9.2018宁波 20 时,四个实验小组分别取不同质量的 NaCl,逐渐加入到各盛有 50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余 NaCl的质量。记录数据如下表:实验小组 第一组 第二组 第三组 第四组水的质量/g 50 50 50 50所取 NaCl的质量/g 15 20 25 30剩余 NaCl的质量/g 0 2 7 12下列说法错误的是 ( )A.20 时,50 g NaCl 饱和溶液中含有 18 g NaClB.用蒸发的方法可以使不饱和溶液变成饱和溶液C.第二组所得溶液的溶质与溶剂的质量比为 925D.相同温度下,NaCl 在水里的溶解度与水的质量无关10.2
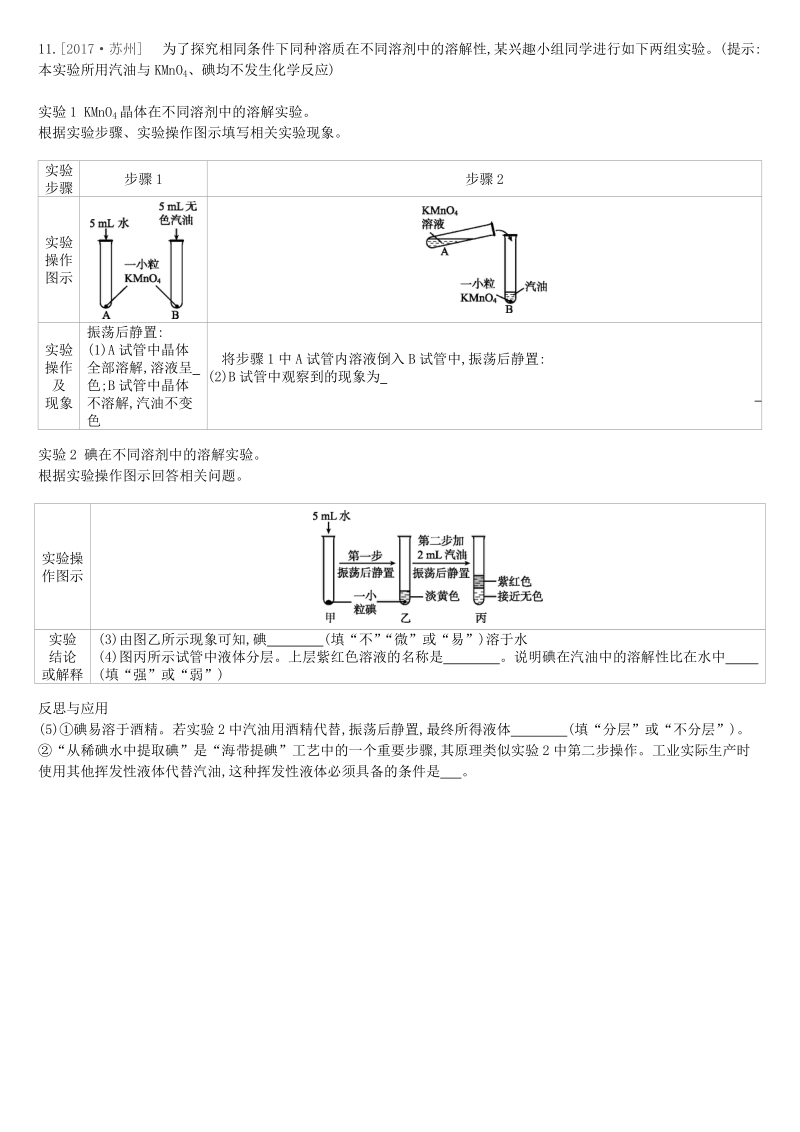
6、018潍坊 M是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图 Z13-4甲所示。某化学兴趣小组用物质 M进行了如图乙所示实验。下列说法不正确的是 ( )图 Z13-4A.物质 M是硝酸钾B.溶液中溶质质量分数为 37.5%C.溶液中,溶质质量分数的关系是D.溶液为不饱和溶液,溶液和为饱和溶液11.2017苏州 为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下两组实验。(提示:本实验所用汽油与 KMnO4、碘均不发生化学反应)实验 1 KMnO4晶体在不同溶剂中的溶解实验。根据实验步骤、实验操作图示填写相关实验现象。实验步骤 步骤 1 步骤 2实验操作图示实验操作


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 江苏省 徐州市 2019 年中 化学 复习 溶解 现象 13 物质 溶解性 课时 训练 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-43952.html