 2016年贵州省遵义市中考化学试卷及答案解析
2016年贵州省遵义市中考化学试卷及答案解析
《2016年贵州省遵义市中考化学试卷及答案解析》由会员分享,可在线阅读,更多相关《2016年贵州省遵义市中考化学试卷及答案解析(16页珍藏版)》请在七七文库上搜索。
1、2016 年贵州省遵义市中考化学试卷一、选择题(苯大题包括 10 个小题,每小题 2 分共 20 分,每小题只有一个正确答案, )1成语是中华民族语言的瑰宝,下列成语中蕴含着化学变化的是( )A木已成舟 B火上浇油 C量体裁衣 D滴水成冰2市场上有“锌硒茶” 、 “含氟牙膏”等商品,这里的“锌、硒、氟”指的是( )A分子 B原子 C单质 D元素3下列叙述错误的是( )A用霉变油菜籽生产食用油B用洗涤剂清洗餐具上的油污,利用了乳化原理C大气中二氧化碳含量升高,会引起“温室效应”D在火场的浓烟中逃生,可用湿毛巾捂住口鼻,蹲下靠近底面或沿墙壁跑离着火区域4下列图示实验操作正确的是( )A滴加液体 B
2、读取液体体积 C浓硫酸稀释 D蒸发结晶5甲醛的水溶液可用于制作标本,下列关于甲醛(CH 2O)的说法正确的是( )A甲醛分子是由碳、氢、氧元素组成B甲醛中氢元素的质量分数最小C甲醛的相对分子质量为 30gD甲醛中碳、氢、氧元素质量比为 1:2:16下列对宏观现象的 微观解释不正确的是( )A “花香四溢 ”说明分子在不断运动B分离液态空气制氧气,说明分子可以再分C碱溶液有许多共同性质,是因为它们的溶液中都含有 OHD金刚石和石墨物理性质存在差异,是因为它们的原子排列方式不同7下列有关物质的鉴别方案错误的是( )A用水鉴别炭粉和二氧化锰B用闻气味的方法鉴别白酒和白醋C用澄清石灰水鉴别氮气和二氧化
3、碳D用相互刻画的方法鉴别黄铜片和铜片8进行下列 对比试验,不需要控制变量的是( )A用红磷和白磷探究可燃物燃烧的条件B用铁钉探究钢铁生锈的条件C用足量稀盐酸区分氯化钾溶液和碳酸钾溶液D用镁、锌与稀硫酸反应,比较镁、锌的金属活动性强弱9下列各组转化中,一定条件下均能一步实现的组合是( )A B C D10向一定量的 Ba(OH) 2 溶液中滴加稀 H2SO4,下列图象能正确描述对应关系的是( )A B C D二、分选择题(苯大题包括 7 小题,11-16 小题没空 1 分,17 小题 5 分,共 40 分)11化学就在我们身边,化学与生活息息相关(1)鸡蛋和牛奶都富含的营养素是 (2)某服装标签
4、上写着“涤纶 56%,棉 44%”,其中属于合成纤维的是 (3)焙制糕点所用的发酵粉主要成分之一小苏打,化学式为 (4)农作物的增产依赖化肥,如常用的花粉 KNO3、CO(NH 2) 2、Ca(H 2PO4) 2 等,其中属于复合肥的是 (5)为了践行“绿色发展” ,遵义市引进了一批新能源公共汽车,其主要装置之一为电池,电池所示将 能转化为电能的装置12水在生活、生产中和化学实验中起着十分重要的作用自来水厂净化水的过程为:取水过滤 吸附消毒,高铁酸钾(K 2FeO4)能用作絮凝剂(1)制备 K2FeO4 的化学方程式为 2Fe(OH) 3+3Cl2+10KOH2K2FeO4+6X+8H2O,则
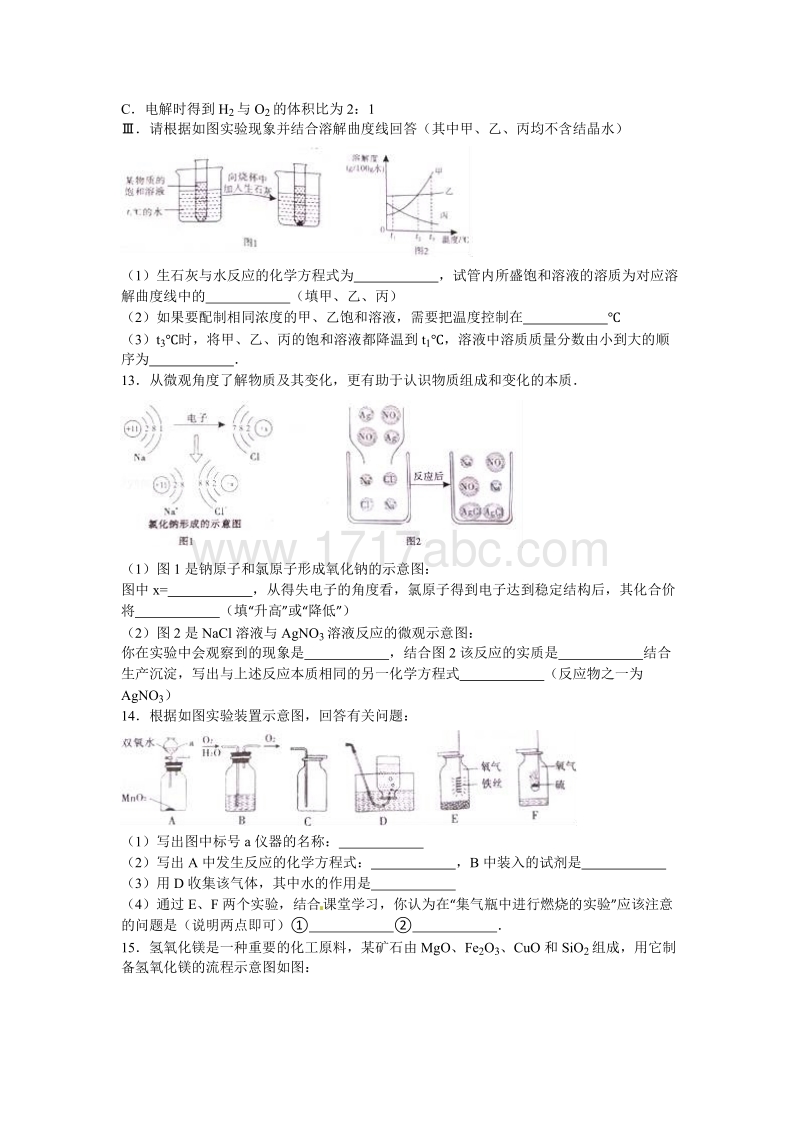
5、 X的化学式为 ,K 2FeO 中铁元素的化合价为 (2)自来水厂净化水的过程 (填“能”、 “不能” )将硬水软化成软水欲证明一瓶无色透明液体是纯净水,可靠的实验方法是 A.1.01105Pa 时沸点为 100B测得其 pH=7C电解时得到 H2 与 O2 的体积比为 2:1请根据如图实验现象并结合溶解曲度线回答(其中甲、乙、丙均不含结晶水)(1)生石灰与水反应的化学方程式为 ,试管内所盛饱和溶液的溶质为对应溶解曲度线中的 (填甲、乙、丙)(2)如果要配制相同浓度的甲、乙饱和溶液,需要把温度控制在 (3)t 3时,将甲、乙、丙的饱和溶液都降温到 t1,溶液中溶质质量分数由小到大的顺序为 13
6、从微观角度了解物质及其变化,更有助于认识物质组成和变化的本质(1)图 1 是钠原子和氯原子形成氧化钠的示意图:图中 x= ,从得失电子的角度看,氯原子得到电子达到稳定结构后,其化合价将 (填“升高” 或“ 降低”)(2)图 2 是 NaCl 溶液与 AgNO3 溶液反应的微观示意图:你在实验中会观察到的现象是 ,结合图 2 该反应的实质是 结合生产沉淀,写出与上述反应本质相同的另一化学方程式 (反应物之一为AgNO3)14根据如图实验装置示意图,回答有关问题:(1)写出图中标号 a 仪器的名称: (2)写出 A 中发生反应的化学方程式: ,B 中装入的试剂是 (3)用 D 收集该气体,其中水的
7、作用是 (4)通过 E、F 两个实验,结合 课堂学习,你认为在“集气瓶中进行燃烧的实验”应该注意的问题是(说明两点即可) 15氢氧化镁是一种重要的化工原料,某矿石由 MgO、Fe 2O3、CuO 和 SiO2 组成,用它制备氢氧化镁的流程示意图如图:(1)请写出步骤一中发生反应的化学方程式: (任写一个)(2)溶液 A 中所含的阳离子有 (填离子符号)(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的 pH 见表沉淀物 Fe(OH) 2 Cu(OH ) 2 Mg(OH) 2开始沉淀 1.9 4.2 9.1完全沉淀 3.2 6.7来源:Z*xx*k.Com 11.1步骤二中加入熟石灰,调节溶液
8、的 pH 范围为 (4)3 个步骤中均用到的操作是 (5)步骤三中生成产品的化学方程式为 16在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用(1) 【推断】观察到 D 中黑色固体变红,则 B 中生成的气体是 (2)探究 B装置中剩余固体成分是什么?【查阅资料】1碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物2铁的氧化物中,只有 Fe2O3 是红棕色,其余均为黑色,只有 Fe3O4 能被磁铁吸引【初步探究】B 装置中剩余固体为黑色,能全部被磁铁吸引【猜想与假设】猜想一:剩余固体是 Fe3O4猜想二
9、:剩余固体是 【实验探究】实验操作 实验现象及结论【实验结论】铁与水蒸气反应的化学方程式为 (3) 【成分再利用】若将 B 装置中剩余的黑色固体 ag,经过一系列转化,全部变为红棕色固体 Fe2O3(假设转化过程中铁元素无损耗) ,增加的质量为 x,则 x 的取值范围为 17实验室用 50%溶质质量分数为 7.3%的稀盐酸与足量的石灰石反应制取二氧化碳,理论上可制得二氧化碳多少克?2016 年贵州省遵义市中考化学试卷参考答案与试题解析一、选择题(苯大题包括 10 个小题,每小题 2 分共 20 分,每小题只有一个正确答案, )1成语是中华民族语言的瑰宝,下列成语中蕴含着化学变化的是( )A木已
10、成舟 B火上浇油 C量体裁衣 D滴水成冰【考点】化学变化和物理变化的判别【分析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断【解答】解:A、木已成舟过程中只 是形状发生改变,没有新物质生成,属于物理变化B、火上浇油过程中有新物质生成,属于化学变化C、量体裁衣过程中只是形状发生改变,没有新物质生成,属于物理变化D、滴水成冰过程中只是状态发生改变,没有新物质生成,属于物理变化故选 B2市场上有“锌硒茶” 、 “含氟牙膏”等商品,这里的“锌、硒、氟”指的是( )A分子 B原子 C单质 D元素【考点】元素的概念【分析】 “
11、锌硒茶” 中的“锌”、 “硒”、 “含氟牙膏中的“氟” 不是以单质、分子、原子、离子等形式存在,而是指元素【解答】解:“锌硒茶” 中的“锌”、 “硒”、 “含氟牙膏中的“氟”不是以单质、分子、原子、离子等形式存在,这里所指的“锌”、 “硒”、 “氟”是强调存在的元素,与具体形态 无关故选 D3下列叙述错误的是( )A用霉变油菜籽生产食用油B用洗涤剂清洗餐具上的油污,利用了乳化原理C大气中二氧化碳含量升高,会引起“温室效应”D在火场的浓烟中逃生,可用湿毛巾捂住口鼻,蹲下靠近底面或沿墙壁跑离着火区域【考点】亚硝酸钠、甲醛等化学品的性质与人体健康;二氧化碳对环境的影响;乳化现象与乳化作用【分析】A根
12、据霉变油菜籽中含有黄曲霉素进行分析;B根据洗涤剂对油污具有乳化作用分析判断C根据造成温室效应的主要物质是二氧化碳进行分析;D根据火灾时烟尘都在室内的上方进行分析【解答】解:A霉变油菜籽含有毒性很大的黄曲霉毒素,有致癌作用,不能用来压榨食用油,故说法错误;B用洗涤剂清洗餐具上的油污是利用了洗涤剂对油污的乳化作用,故说法正确C大气中二氧化碳含量升高,会引起“温室效应”,故说法正确;D发生火灾时,室内的上方有大量的烟尘和有毒的气体,在火场的浓烟中逃生,可用湿毛巾捂住口鼻,蹲下靠近底面或沿墙壁跑离着火区,故说法正确故选 A4下列图示实验操作正确的是( )A滴加液体 B读取液体体积 C浓硫酸稀释 D蒸发
13、结晶【考点】蒸发与蒸馏操作;测量容器-量筒;液体药品的取用;浓硫酸的性质及浓硫酸的稀释【分析】A、根据使用胶头滴管滴加少量液体的方法进行分析判断B、根据量筒读数时视线要与凹液面的最低处保持水平进行分析判断C、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断D、根据蒸发操作的注意事项进行分析判断【解答】解:A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误B、量取液体时,视线与液体的凹液面最低处保持水平,图中俯视刻度,操作错误C、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻
14、璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作正确D、蒸发时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液体飞溅,图中所示操作错误故选:C5甲醛的水溶液可用于制作标本,下列关于甲醛(CH 2O)的说法正确的是( )A甲醛分子是由碳、氢、氧元素组成B甲醛中氢元素的质量分数最小C甲醛的相对分子质量为 30gw w w .x k b 1.c o mD甲醛中碳、氢、氧元素质量比为 1:2:1【考点】化学式的书写及意义;相对分子质量的概念及其计算;元素质量比的计算;元素的质量分数计算【分析】A根据分子的结构来分析;B根据化合物中元素质量比来分析;C根据相对分子质量的单位来分析
15、;D根据化合物中各元素质量比 =各原子的相对原子质量原子个数之比,进行分析判断【解答】解:A分子是由原子构成的,而不是由元素组成的,故错误;B甲醛中碳、氢、氧三种元素质量比为(12 1):(12):(161)=6:1:8,由此可见,其中氢元素的质量分数最小,故正确;C相对分子质量的单位不是“g”而是“1”,通常省略不写,故错误;D甲醛中碳、氢、氧三种元素质量比为( 121):(12):(161)=6:1:8,故错误故选 B6下列对宏观现象的微观解释不正确的是( )A “花香四溢 ”说明分子在不断运动B分离液态空气制氧气,说明分子可以再分C碱溶液有许多共同性质,是因为它们的溶液中都含有 OHD金
16、刚石和石墨物 理性质存在差异,是因为它们的原子排列方式不同【考点】利用分子与原子的性质分析和解决问题【分析】根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”,结合事实进行分析判断即可【解答】解:A、 “花香四溢” ,是因为花香中含有的分子是在不断运动的,向四周扩散,使人们闻到花香,故选项解释正确B、分离液态空气制氧气,属于物理变化,分子本身没有发生变化,故选项解释错误C、碱溶液有许多共同性质,是因为它们的溶液中都含有 OH,故选项解释正确D、金刚石和石墨物理性质存在差异,是因为它们的碳原子
17、排列方式不同,故选项解释正确故选:B7下列有关物质的鉴别方案错误的是( )A用水鉴别炭粉和二氧化锰B用闻气味的方法鉴别白酒和白醋C用澄清石灰水鉴别氮气和二氧化碳 w w w .x k b 1.c o mD用相互刻画的方法鉴别黄铜片和铜片【考点】物质的鉴别、推断;常见气体的检验与除杂方法;合金与合金的性质【分析】根据三种物质与同种试剂反应产生的不同现象来鉴别它们,若两种物质与同种物质反应的现象相同,则无法鉴别它们【解答】解:A、炭粉和二氧化锰均难溶于水,用水不能鉴别,故选项正确B、白酒和白醋分别具有酒的芳香气味、酸味,用闻气味的方法可以鉴别,故选项错误C、二氧化碳能使澄清石灰水变浑浊,氮气不能,
18、可以鉴别,故选项错误D、黄铜片是铜的合金,用相互刻画的方法可以鉴别黄铜片和铜片,可以鉴别,故选项错误故选:A8进行下列对比试验,不需要控制变量的是( )A用红磷和白磷探究可燃物燃烧的条件B用铁钉探究钢铁生锈的条件C用足量稀盐酸区分氯化钾溶液和碳酸钾溶液D用镁、锌与稀硫酸反应,比较镁、锌的金属活动性强弱【考点】科学探究的基本方法【分析】根据控制变量法进行对比要有一个变量,其它条件必须相同进行分析【解答】解:A、探究可燃物燃烧的条件时,均与氧气接触,只是可燃物的着火点不同,属于控制变量法;B、探究铁生锈的条件时,要控制好水、氧气等变量,属于控制变量法;C、氯化钾不与盐酸反应,碳酸钾与盐酸反应生成二
19、氧化碳气体,无需控制变量;D、此实验中,金属片的长度、厚薄、稀硫酸的浓度均相同,只是金属的种类不同,根据反应生成气泡的速率来判断金属的活动性,属于控制变量法故选 C9下列各组转化中,一定条件下均能一步实现的组合是( )A B C D【考点】物质的相互转化和制备;氧气的化学性质;二氧化碳的化学性质;一氧化碳的化学性质;碱的化学性质;盐的化学性质【分析】一步反应实现即原物质只发生一个反应即可转化为目标物质,根据所涉及物质的性质,分析能否只通过一个反应而实现即可【解答】解:一氧化碳燃烧生成二氧化碳,二氧化碳发生光合作用生成氧气,碳在氧气中充分燃烧生成二氧化碳,碳在氧气中不充分燃烧生成一氧化碳,一定条
20、件下均能一步实现氢气与氧化镁反应生成镁和水,氢气燃烧生成水,水通电分解生成氢气和氧气,镁在氧气中燃烧生成氧化镁,一定条件下均能一步实现硫酸钠与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化钠,氢氧化钠与二氧化碳反应生成碳酸钠和水,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸钠与硫酸反应生成硫酸钠和水,一定条件下均能一步实现故均能一步实现故选:D10向一定量的 Ba(OH) 2 溶液中滴加稀 H2SO4,下列图象能正确描述对应关系的是( )A B C D【考点】中和反应及其应用;溶液的导电性及其原理分析;溶液的酸碱性与 pH 值的关系【分析】硫酸与氢氧化钡反应会生成水与硫酸钡沉淀,随着反应的进行,
21、沉 淀质量会增多,直至恰好反应,沉淀量不再改变;氢氧化钡溶液呈碱性,pH 大于 7,硫酸的 pH 小于 7,向碱中加酸,溶液的 pH 会逐渐变小根据上述规律,结合图象进行判断【解答】解:A、氢氧化钡显碱性,pH7,随着酸量的增加溶液的碱不断减少, pH 值变小,直至恰好反应 pH=7,再加入稀硫酸酸性不断增强,pH 小于 7,图象错误,故此选项错误B、硫酸与氢氧化钡反应会生成水与硫酸钡沉淀,随着反应的进行沉淀量不断增大,直至恰好反应,沉淀量不再改变,图象错误,故此选项错误C、氢氧化钡与硫酸反应生成硫酸钡和水,硫酸钡属于沉淀,不能导电,水几乎不能导电,所以氢氧化钡与硫酸恰好完全反应时,导电性减弱


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2016 贵州省 遵义市 中考 化学 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 贵州省遵义市汇川区
- 遵义市第二十一中学
- 贵州省印江中学
- 贵州省遵义市凤冈县第一中学
- 贵州省遵义市道真县齐心小学2020-2021
- 遵义市2020至2021
- 2020届贵州省遵义市绥阳县高三一模
- 2020届贵州省遵义市绥阳县高三一模理综
- 贵州省贵定一中原贵定县第三中学
- 贵州省导向权威
- 贵黔第一卷2021年遵义市模拟卷(二)语文
- 2016年贵州省遵义市中考数学试卷含答案解析
- 2016年贵州省黔南中考化学试卷及答案解析
- 2019年贵州省遵义市中考化学试卷含详细答案
- 2018年贵州省遵义市中考政治试卷含解析
- 2016年贵州省遵义市中考化学试卷及答案解析
- 2016年贵州省安顺市中考化学试卷及答案解析
- 2018年贵州省遵义市中考物理试卷及答案解析
- 2016年贵州省安顺市中考物理试卷及答案解析
- 2020年贵州省遵义市中考历史试卷含答案解析



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-3618.html