 课题2《原子的结构》精品课件
课题2《原子的结构》精品课件
《课题2《原子的结构》精品课件》由会员分享,可在线阅读,更多相关《课题2《原子的结构》精品课件(33页珍藏版)》请在七七文库上搜索。
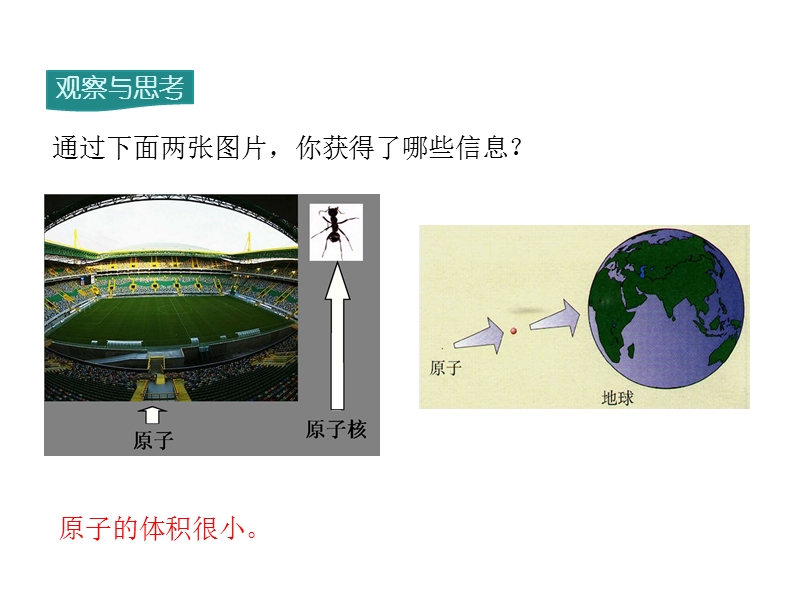
1、,第三单元 物质构成的奥秘,课题2 原子的结构,通过下面两张图片,你获得了哪些信息?,原子的体积很小。,观察图片,你发现了什么?,1.原子不是一个实心球体。 2.原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成的。,一、原子的构成,3.原子核又是由带正电荷的质子和不带电的中子构成的。 4.一个质子带1个单位的正电荷,一个电子带1个单位的负电荷。,观察下表,你有什么发现?,(1)原子中,质子数=核外电子数=核电荷数;,(2)原子中的质子数不一定等于中子数;,(3)不是所有的原子都含有中子,如普通氢原子中不含有中子。,原子中存在着带电的粒子,为什么整个原子不显电性?,由于原子里质子数
2、等于电子数,一个质子和一个电子所带的电量相等,电性相反,所以整个原子不显电性。,【例题】下列关于原子的说法正确的是( ) A原子核带负电,核外电子带正电 B是化学变化中的最小粒子 C原子都是由质子、中子和电子构成的 D原子的质子数和中子数相同,分析:原子是由带正电的原子核和核外带负电的电子构成的,大多数原子的原子核中含有质子和中子,极少数原子的原子核中不含有中子,所以原子的质子数和中子数不一定相同,故 A、C、D 三项错误,B 项正确。,B,2.已知原子的核电荷数,可以确定它的( ) A.相对原子质量 B.质子数 C.中子数 D.电子数,BD,1.原子(普通的氢除外)的原子核是( ) A.由电
3、子和质子构成 B.由质子和中子构成 C.由电子和中子构成 D.不能再分,B,观察电子分层排布示意图,你有什么发现?,1.核外电子的分层排布,二、原子核外电子的排布,电子层离核远近能量高低,二 三 四 五 六 七,低 高,近 远,离核最远的叫做最外层。,最外层电子数不超过8个,只有一层的,电子数不超过2个。,电子在原子核外是分层排布的。,2.原子结构示意图,原子结构示意图可以直观、形象地表示电子的分层排布。以硫原子结构示意图为例:,硫原子结构示意图,原子核,核电核数,电子层,该电子层上电子数,观察118号元素的原子结构示意图,你发现原子种类与原子结构有何关系吗?,原子种类与原子结构的关系:,8个
4、(He为2个),比较稳定,一般少于4个,一般多于4个,不稳定,不稳定,易失电子,易得电子,既不易得电子,也不易失电子,稳定,不稳定,不稳定,原子的最外层电子数决定原子的化学性质。,【例题】下列五种微粒中,最易失去电子的是 (填字母序号,下同),最易得到电子的是 ,已达到稳定结构的是 。元素化学性质比较相似的是 。,分析:最外层电子数少于 4 的原子容易失去电子,最外层电子数多于 4 的原子容易得到电子,最外层电子数为8(只有一个电子层时电子数为2)的结构为稳定结构,最外层电子数相同的元素化学性质相似。,AC,E,BD,BD,2.右图为氯原子的结构示意图,下列有关说法错误的是( ) A氯原子的核
5、电荷数为17 B氯原子最外层有7个电子 C氯原子的质子数为17 D在化学反应中氯原子容易失去电子,D,1.原子是由多种微粒构成的,而决定元素化学性质的是 ( ) A核外电子数 B最外层电子数 C质子数 D中子数,B,金属元素原子和非金属元素原子最外层电子未排满,要趋向稳定,怎么样才能达到稳定呢?,三、离 子,1.离子的定义:带电的原子(或原子团)叫做离子。,2.离子的形成:,阴离子(-),阳离子(+),原子,失去1个电子,得到1个电子,4.离子的分类,离子,阳离子带正电荷,如Na 、Ca2,阴离子带负电荷,如Cl、SO42,3.离子的符号及其意义:,在元素符号或原子团的右上角标出离子所带的电荷


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 课题 原子 结构 精品 课件
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-30263.html