 2023年四川省内江市中考化学试卷(含答案解析)
2023年四川省内江市中考化学试卷(含答案解析)
《2023年四川省内江市中考化学试卷(含答案解析)》由会员分享,可在线阅读,更多相关《2023年四川省内江市中考化学试卷(含答案解析)(14页珍藏版)》请在七七文库上搜索。
1、2023年四川省内江市中考化学试卷可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 Ca-40A卷一、选择题(本大题共12个小题,每小题4分,共48分。)1. 下列过程涉及化学变化的是A. 铜丝导电B. 玻璃破碎C. 酒精挥发D. 食物腐烂2. 化学与环境保护息息相关。下列做法错误的是A. 开发新能源,减少化石燃料使用B. 生活污水集中处理达标后排放C. 露天焚烧塑料垃圾D. 使用公共交通出行,践行“低碳生活”3. 2023年5月30日我国成功发射神舟十六号载人飞船,其火箭中的N2O4属于A. 酸B. 碱C. 盐D. 氧化物4. 空气是一种重要的资源。下列有关空气成分的说法错
2、误的是A. 氮气充入食品包装袋中可延长其保质期B. 二氧化碳是形成酸雨的主要污染物C. 稀有气体可用于制造电光源D 氧气能供给生物呼吸,支持燃料燃烧5. 下列化学用语表达正确的是A. 2个钠离子:2NaB. 3个氮原子:N3C. SO2中氧元素的化合价:D. 氯化锌的化学式:ZnCl6. “民以食为天,食以安为先”。下列有关说法正确的是A. 纤维素不能被人体吸收,因此不必食用富含纤维素的蔬菜B. 蛋白质是人体所需的营养物质之一C. 变质的油脂也能提供能量,可大量食用D. 奶茶具有良好的口感,可以代替饮用水长期饮用7. 下列有关物质的性质或用途说法正确的是A. 干冰可用作制冷剂B. 铁丝能在空气
3、中燃烧生成氧化铁C. 铜与盐酸反应生成氯化铜和氢气D. 碳酸氢铵受热不易分解,可作氮肥8. 如图为铝原子结构示意图。下列有关铝原子的说法正确的是 A. 图中“+”表示铝原子带正电B. 铝原子的质量主要集中在核外13个电子上C. 铝原子在化学反应中易得到电子D. 铝原子核外有3个电子层9. 金属材料在人类活动中有着广泛的应用。下列有关说法正确的是A. 合金中只含金属元素B. 金能压成很薄的片,说明金的熔点高C. 在锅铁表面涂油漆,可减缓钢铁的锈蚀D. 铁能从ZnSO4、CuSO4的溶液中置换出锌和铜10. 甲、乙两种物质的溶解度曲线如图所示,下列有关说法错误的是 A. 两种物质的溶解度都随温度升
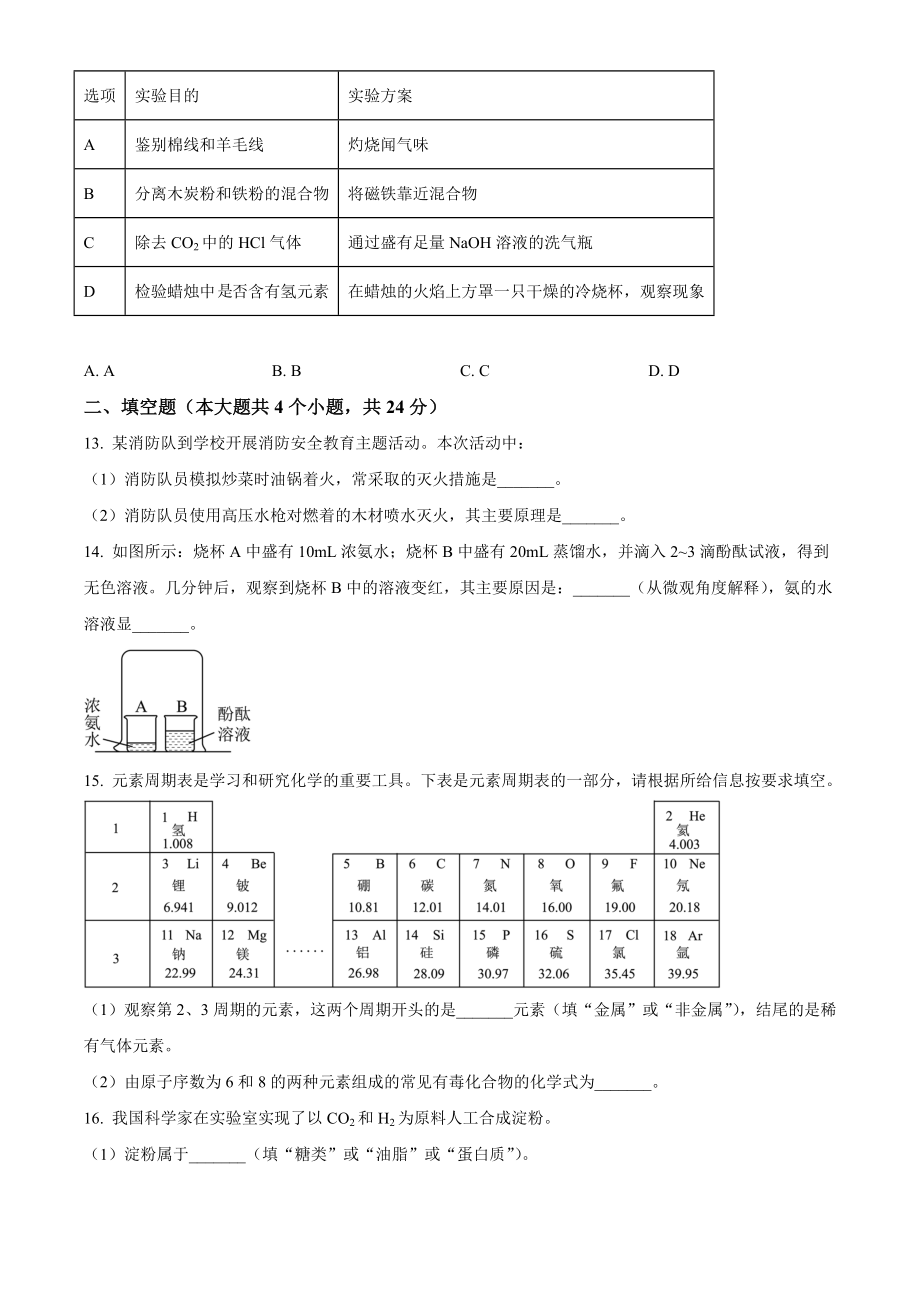
4、高而增大B. t1C时,甲、乙两物质的溶液中溶质质量分数一定相等C. 通常采用蒸发结晶的方法从乙的溶液中获得晶体D. t2C时,在100g水中加入25g甲,可形成甲的不饱和溶液11. 下列有关物质及变化的叙选正确的是A. 将稀硝酸不断滴入NaOH溶液中,溶液的pH减小B. 生石灰露置于空气中其成分不会发生变化C. Na2CO3溶液能使紫色石蕊试液变红D. 浓硫酸敞口放置于空气中,溶质质量分数会变大12. 下列实验方案不能达到实验目的的是选项实验目的实验方案A鉴别棉线和羊毛线灼烧闻气味B分离木炭粉和铁粉的混合物将磁铁靠近混合物C除去CO2中的HCl气体通过盛有足量NaOH溶液的洗气瓶D检验蜡烛中
5、否含有氢元素在蜡烛的火焰上方罩一只干燥的冷烧杯,观察现象A. AB. BC. CD. D二、填空题(本大题共4个小题,共24分)13. 某消防队到学校开展消防安全教育主题活动。本次活动中:(1)消防队员模拟炒菜时油锅着火,常采取的灭火措施是_。(2)消防队员使用高压水枪对燃着的木材喷水灭火,其主要原理是_。14. 如图所示:烧杯A中盛有10mL浓氨水;烧杯B中盛有20mL蒸馏水,并滴入23滴酚酞试液,得到无色溶液。几分钟后,观察到烧杯B中的溶液变红,其主要原因是:_(从微观角度解释),氨的水溶液显_。 15. 元素周期表是学习和研究化学的重要工具。下表是元素周期表的一部分,请根据所给信息按要求
6、填空。 (1)观察第2、3周期的元素,这两个周期开头的是_元素(填“金属”或“非金属”),结尾的是稀有气体元素。(2)由原子序数为6和8的两种元素组成的常见有毒化合物的化学式为_。16. 我国科学家在实验室实现了以CO2和H2为原料人工合成淀粉。(1)淀粉属于_(填“糖类”或“油脂”或“蛋白质”)。(2)CO2作为资源利用是实现“碳中和”的有效方法。在一定条件下,以CO2和H2为原料可合成甲醇(CH3OH)和水,写出该反应的化学方程式_。三、实验题(本大题共18分)17. 下图是实验室制取气体常用的发生和收集装置,请回答有关问题。 (1)写出图中标注仪器的名称:_;_。(2)实验室选用装置BD
7、组合制取并收集氧气,其反应的化学方程式为_,当D中集气瓶里的水排完后,在水里用玻璃片_(填“磨砂”或“光滑”)一面盖住集气瓶口,将集气瓶移出水面,_(填“正放”或“倒放”)在桌面上。(3)用加热高锰酸钾固体的方法制取并收集氧气,可选_装置和E装置,验满的方法是_。(4)实验室若用装置C制取二氧化碳,加盐酸时液面高度至少应该在_(填“a”或“b”)处以上:检验二氧化碳时,将气体通入澄清石灰水变浑浊的化学方程式为_。四、计算题(本大题共10分)18. 钙是人体必需的常量元素,人体缺钙时可适当使用补钙剂。碳酸钙(CaCO3)、乳酸钙(C6H10O6Ca)是补钙剂中常用的含钙物质。(1)乳酸钙中氢原子
8、和氧原子的个数比为_(填最简整数比,下同),碳元素和钙元素的质量比为_。(2)碳酸钙中钙元素质量分数为_;从元素质量分数的角度推断,用_(填物质名称)做补钙剂中的含钙物质更好。B卷19. 镁、纯碱在工业生产中有广泛的用途。某地的菱镁矿中主要含MgCO3及少量FeCO3、Al2O3和SiO2,以菱镁矿等为原料制取镁、纯碱的工艺流程如图。请回答下列问题: (1)在反应中,为了加快反应速率,选用_(填“块状”或“粉末状”)菱镁矿:写出菱镁矿中碳酸镁与盐酸反应的化学方程式_。(2)向饱和食盐水中通入NH3、CO2气体时,需加压通入的气体是_;在反应中均发生_反应(填化学反应基本类型)。(3)此工艺条件
9、下金属离子开始沉淀和沉淀完全时的pH如下表所示:金属离子Mg2+ Al3+Fe3+开始沉淀的pH8.93.41.5沉淀完全的pH10.94.72.8向a溶液中通入足量空气后,溶液中_元素化合价发生了改变:向b溶液中加MgO调节溶液pH,调pH范围为_。20. 实验室通常用溶质质量分数15%的稀盐酸和碳酸钙反应来制取CO2,某化学兴趣小组提出:若将稀盐酸改为极稀盐酸结果又如何呢?【猜想与假设】猜想一:有较多CO2放出猜想二:无CO2放出,有新物质生成猜想三:无CO2放出,_。【查阅资料】 【实验探究】用溶质质量分数0.050%极稀盐酸进行如下实验探究: 实验步骤实验现象实验结论或解释如图,将纯碳
10、酸钙和0.050%的盐酸混和,放置一段时间,观察现象,再过滤玻璃管内液面不移动猜想一_取滤液放在蒸发皿中加热浓缩并蒸干有白色固体出现猜想二成立,有新物质生成的理由是:_取滤液于试管中滴加饱和碳酸钠溶液有白色沉淀生成滤液中含有_离子取滤液于试管中滴加饱和澄清石灰水滤液变浑浊滤液中含有_离子在实验中,极稀盐酸与碳酸钙反应的化学方程式为_。继续用不同浓度的极稀盐酸做重复实验。【实验结论】实验室不能选用极稀盐酸与碳酸钙反应来制取CO2【拓展应用】酸雨腐蚀建筑物可用碳酸钙能与极稀酸反应的原理解释。21. 漂白粉是一种常用杀菌消毒剂和漂白剂,其有效成分是次氯酸钙【Ca(ClO)2】。生产原理是:。某化工厂
11、将1420kg氯气通入盛有过量冷消石灰的密闭容器中被完全吸收,反应后容器中所有物质形成的混合物即为漂白粉,其质量为4000kg,请回答下列问题:(1)密闭容器中盛放的消石灰质量是_kg。(2)该漂白粉中次氯酸钙的质量是多少kg?(写出计算过程,下同)(3)该漂白粉中+1价氯元素的质量分数是多少?答案解析A卷一、选择题(本大题共12个小题,每小题4分,共48分。)1. 【答案】D【解析】A.铜丝导电过程中没有新物质生成,属于物理变化,该选项不符合题意;B.玻璃破碎过程中没有新物质生成,属于物理变化,该选项不符合题意;C.酒精挥发过程中没有新物质生成,属于物理变化,该选项不符合题意;D.食物腐烂过
12、程中有新物质生成,属于化学变化,该选项符合题意。故选D。2. 【答案】C【解析】A.开发新能源,减少化石燃料的使用,能减少污染物的排放,有利于环境保护,故选项做法正确;B.生活污水集中处理达标后排放,可以防止水体污染,有利于环境保护,故选项做法正确;C.露天焚烧塑料垃圾,会产生大量有害气体和烟尘,不利于环境保护,故选项做法不正确;D.使用公共交通出行,践行“低碳生活”,既能节约资源,又能减少污染物的排放,有利于环境保护,故选项做法正确。故选C。3. 【答案】D【解析】A.酸是电离时产生的阳离子都是氢离子的化合物,不符合题意;B.碱是电离时产生的阴离子都是氢氧根离子的化合物,不符合题意;C.盐是
13、由金属离子(或铵根离子)与酸根离子构成的化合物,不符合题意;D.N2O4是由N、O元素组成的化合物,属于氧化物,符合题意。故选D。4. 【答案】B【解析】A.氮气的化学性质稳定,一般不与其它物质反应,充入食品包装袋中可延长其保质期,故选项说法正确;B.二氧化硫、二氧化氮是形成酸雨的主要污染物,而空气中二氧化碳含量过多,会加剧温室效应,故选项说法不正确;C.稀有气体通电时能发出不同颜色的光,可用于制造电光源,故选项说法正确;D.空气中的氧气能供给生物呼吸,支持燃料燃烧,故选项说法正确。故选B。5. 【答案】C【解析】A.钠离子的化学符号为Na+,所以2个钠离子为2Na+,说法错误;B.根据原子的


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2023 四川省 内江市 中考 化学 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-245999.html