 2023年4月广东省深圳市宝安区中考二模化学试卷(含答案解析)
2023年4月广东省深圳市宝安区中考二模化学试卷(含答案解析)
《2023年4月广东省深圳市宝安区中考二模化学试卷(含答案解析)》由会员分享,可在线阅读,更多相关《2023年4月广东省深圳市宝安区中考二模化学试卷(含答案解析)(21页珍藏版)》请在七七文库上搜索。
1、2023年4月广东省深圳市宝安区中考二模化学试题可能用到的相对原子质量:C-12H-1O-16Cu-64S-32一、单项选择题:(共12小题,1-8每小题1.5分,9-12每小题2分,共20分。)1. 2023年深圳宝安马拉松于3月19日举行。有关说法不正确的是A. 发令枪内含有红磷,鸣枪时产生白烟的过程是物理变化B. 赛道补给的云片糕、花生糖等可提供能量C. 跑步后的急促呼吸,属于缓慢氧化D. 赛后将废弃物回收再利用,体现可持续发展理念2. 下列化学用语表述正确的是A. 2个氧分子:2CB. 铵根离子:C. 氧化钙中钙元素化合价:D. 铝片在空气中被氧化3. 如图是元素周期表的一部分。相关说
2、法不正确的是A. 磷元素的相对原子质量为30.97B. 处的数字应为16,可推知硫原子的质子数为16C. 硒元素属于金属元素D. 硒原子核外有34个电子4. 2023年“世界水日”“中国水周”的主题为“强化依法治水、携手共护母亲河”。有关水的说法正确的是A. 水分子由氢元素和氧元素构成B. 工业废水应处理达标后再排放C. 使用活性炭对河水进行杀菌消毒D. 禁止化肥和农药的使用,以免污染水资源5. 剧烈运动后肌肉酸痛是部分葡萄糖(C6H12O6)转化成乳酸(C3H6O3)引起的,有关说法正确的是A. 葡萄糖(C6H12O6)中含有6个氧原子B. 葡萄糖(C6H12O6)中碳、氢、氧元素的质量比为
3、1:2:1C. 乳酸(C3H6O3)在体内完全氧化的产物是CO和H2OD. 葡萄糖(C6H12O6)和乳酸(C3H6O3)中,氢元素的质量分数相等6. 高压臭氧除甲醛()反应的微观图示如下。有关说法正确的是A. 属于氧化物B. 反应I中,反应前后氧原子个数增加C. 反应II中,参加反应的反应物分子的个数比为1:1D. 整个过程中,O2可循环使用7. 下列陈述1与陈述II均正确,且具备因果关系的是选项陈述陈述A石墨具有导电性石墨常用作铅笔芯B厨余垃圾含N、P、K等元素厨余垃圾制花肥C铝化学性质比铁活泼铝比铁更耐腐蚀D氢氧化钠能与酸反应氢氧化钠常用于改良酸性土壤A. AB. BC. CD. D8.
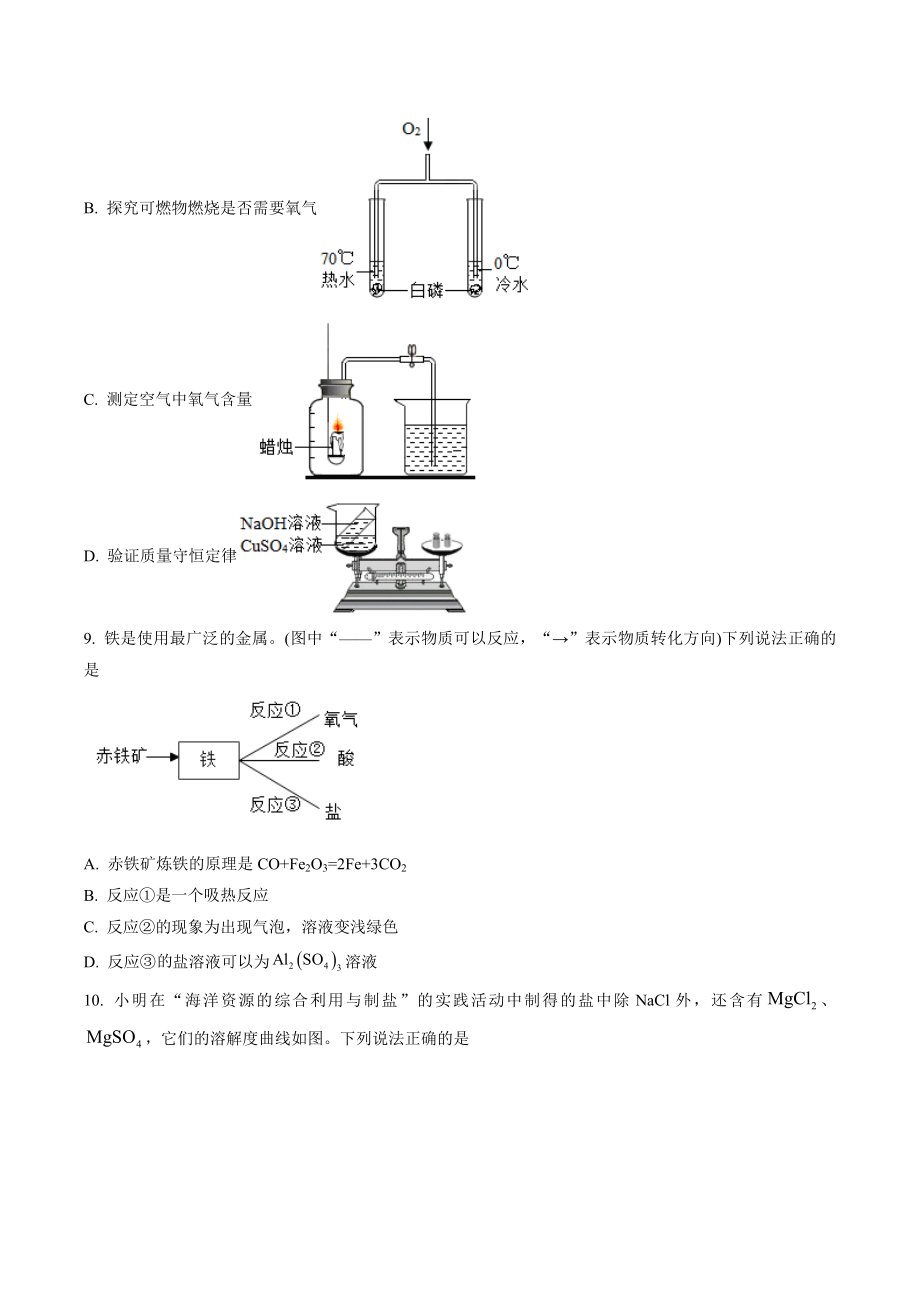
4、 下列设计能达到实验目的的是A. 探究铁生锈是否需要水B. 探究可燃物燃烧是否需要氧气C. 测定空气中氧气含量D. 验证质量守恒定律9. 铁是使用最广泛的金属。(图中“”表示物质可以反应,“”表示物质转化方向)下列说法正确的是A. 赤铁矿炼铁的原理是CO+Fe2O3=2Fe+3CO2B. 反应是一个吸热反应C. 反应的现象为出现气泡,溶液变浅绿色D. 反应盐溶液可以为溶液10. 小明在“海洋资源的综合利用与制盐”的实践活动中制得的盐中除NaCl外,还含有、,它们的溶解度曲线如图。下列说法正确的是A. 溶解度最小的是NaClB. 40C时,MgCl2溶液中溶质的质量分数为57.5%C. 70C时
5、,MgSO4饱和溶液升高温度或降低温度都可能析出晶体D. 从含有NaCl、MgCl2、MgSO4的溶液中提取NaCl可采用降温结晶的方法11. 下列实验方法能达到实验目的的是选项实验目的实验方法A鉴别NaOH和NH4NO3取样,加水溶解,测温度B检验工业废水中是否含有硫酸取样,滴加无色酚酞溶液,观察颜色C除去O2中的水蒸气通过足量的稀硫酸D分离Na2CO3和NaCl的混合物溶解后过滤,洗涤滤渣,蒸发滤液A. AB. BC. CD. D12. 如图1所示,分别将等体积H2O、NaOH溶液注入充满CO2的锥形瓶,测得气压变化如图2。有关说法不正确的是A. 曲线表示的是将H2O注入充满CO2的锥形瓶
6、后的气压变化B. 由曲线可知,反应后锥形瓶内的CO2仍有剩余C. 对比曲线和可知,CO2能与NaOH溶液反应D. A点表示CO2与锥形瓶内的溶液恰好完全反应,则此时溶液pH=7二、非选择题(本大题含4个小题,共30分)13. 根据下图回答:(1)图甲中,可用于实验室制取氧气的途径有_(用“”填写),其中,从环保和节约资源的角度分析,实验室制取O2的最佳途径的反应原理_(写化学方程式)。(2)在图乙的装置中,装置_。(填“A”“B”“C”)既可以用来制取O2,又可用于制取CO2.选用该装置制取CO2的化学方程式为_。(3)查阅资料可知:浓氨水受热易分解产生NH3;NH3密度比空气小。实验室常用C
7、aO和浓氨水可快速制取NH3的原因是_,但利用该方法不能用装置B制取NH3,理由是_。14. 化学小组对过氧碳酸钠(Na2CO4)性质进行探究。【查阅资料】(1)iNa2CO4与H2O反应可生成Na2CO3和H2O2.该反应的化学方程式为_。iiNa2CO4与酸反应产生气体。iiiNa2CO4的产品优劣可用“活性氧”衡量,活性氧含量越高,产品越优。【提出问题】Na2CO4与稀硫酸反应的气体产物是什么?【形成假设】(2)猜想一:只有O2;猜想二:只有CO2;猜想三:_【设计并进行实验】(3)组装如下图所示的装置进行实验。i实验前,先通一段时间N2,再点燃酒精灯。通N2的目的是_。ii打开分液漏斗
8、的活塞,将稀硫酸滴入锥形瓶中。装置B中的溶液为_,装置B中反应的化学方程式为_。【现象与结论】(4)装置B中溶液变浑浊,装置C中固体变成黑色,说明_(填“猜想一”“猜想二”或“猜想三”)成立【思考与交流】(5)Na2CO4可由Na2CO3和H2O2制得,反应温度对产率、活性氧含量的影响如图,由图可知最佳反应温度的范围是_。A. 5-10CB. 10-15C. 15-20D. 20-2515. 利用磷尾矿粉(主要成分为MgCO3、CaCO3等)制备Mg(OH)2的流程如下:查阅资料:iMgCO3的化学性质与CaCO3类似;iiMg(OH)2难溶于水。(1)过程I中MgCO3反应的化学方程式为_,
9、属于_反应(填基本反应类型)。(2)过程IV分离出Mg(OH)2固体的操作是_。(3)过程IV的化学方程式为_。(4)该制备流程中最终产品除获得Mg(OH)2外,还可以获得一种物质_(写物质名称)用作肥料。(5)如图表示碳元素的部分化合价与物质类别的关系,CaCO3中碳元素的化合价可表示为点_(填“a-e”中的一个字母)。(6)制取Mg(OH)2方法还有很多种,在下表中写出合适的反应物。反应物1反应物2_NaOH16. 铜及其化合物广泛应用于生活生产中。(1)青铜属于_(填“金属单质”或“合金”)。(2)Cu、CuO、CuSO4三种物质的转化关系如图甲所示:反应II中,CuO与稀硫酸反应的现象
10、是_。反应III中,_(填化学式)可将CuO一步转化为Cu。图乙所示的实验中,将铜片浸入_(填化学式)溶液中,可根据现象证明Cu的金属活动性比Ag强。(3)往四个都装有15g样品(只含Cu和CuO)的烧杯中,分别加入不同质量的稀硫酸,反应过程中的质量关系如下表所示,计算所用稀硫酸的溶质质量分数。烧杯序号一二三四稀硫酸的质量/g50100150200剩余固体质量ig117332023年4月广东省深圳市宝安区中考二模化学试题可能用到的相对原子质量:C-12H-1O-16Cu-64S-32一、单项选择题:(共12小题,1-8每小题1.5分,9-12每小题2分,共20分。)1. 2023年深圳宝安马拉
11、松于3月19日举行。有关说法不正确的是A. 发令枪内含有红磷,鸣枪时产生白烟的过程是物理变化B. 赛道补给的云片糕、花生糖等可提供能量C. 跑步后的急促呼吸,属于缓慢氧化D. 赛后将废弃物回收再利用,体现可持续发展理念【答案】A【解析】【详解】A、发令枪内含有红磷,鸣枪时产生白烟的过程是红磷与空气中的氧气发生燃烧生成五氧化二磷,该过程有新物质生成,属于化学变化,选项错误;B、赛道补给的云片糕、花生糖等富含糖类,可提供能量,选项正确;C、虽然跑步后的急促呼吸,但吸入体内的氧气与体内的物质的反应较慢,属于缓慢氧化,选项正确;D、赛后将废弃物回收再利用,提高了资源的使用率,体现可持续发展理念,选项正
12、确,故选A。2. 下列化学用语表述正确的是A. 2个氧分子:2CB. 铵根离子:C. 氧化钙中钙元素的化合价:D. 铝片在空气中被氧化【答案】C【解析】【详解】A、1个氧分子由2个氧原子构成,则氧分子的符号为O2,表示多个分子时,在相应的分子符号前面写出分子数目即可,所以2个氧分子的符号为2O2,选项错误;B、1个铵根离子中含有1个氮原子和4个氢原子,且1个铵根离子带1个单位的正电荷,所以铵根离子的符号为 ,选项错误;C、标化合物中某元素的化合价时,先写出化合物的化学式,然后在相应的元素符号的正上方先写出化合价的符号,再写出化合价的数值,氧化钙中钙元素的化合价为+2价,所以氧化钙中钙元素的化合
13、价标为,选项正确;D、铝片在空气中被氧化为氧化铝,反应的化学方程式写为:4Al+3O2=2Al2O3,选项错误,故选C。3. 如图是元素周期表的一部分。相关说法不正确的是A. 磷元素相对原子质量为30.97B. 处的数字应为16,可推知硫原子的质子数为16C. 硒元素属于金属元素D. 硒原子核外有34个电子【答案】C【解析】【详解】A、根据磷元素周期表中的一格可知,汉字下面的数字表示相对原子质量,磷元素的相对原子质量为30.97,故选项说法正确;B、元素周期表是按原子序数递增的顺序排列的,处的数字应为16,原子中原子序数=核电荷数=质子数,可推知硫原子的质子数为16,故选项说法正确;C、硒带“
14、石”字旁,属于固态非金属元素,故选项说法错误;D、根据硒元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数为34,根据原子中原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为34,故选项说法正确。故选C。4. 2023年“世界水日”“中国水周”的主题为“强化依法治水、携手共护母亲河”。有关水的说法正确的是A. 水分子由氢元素和氧元素构成B. 工业废水应处理达标后再排放C. 使用活性炭对河水进行杀菌消毒D. 禁止化肥和农药的使用,以免污染水资源【答案】B【解析】【详解】A、水由氢元素和氧元素组成,说法错误;B、工业废水应处理达标后再排放,减少水体污染,说法正确;C
15、、活性炭具有疏松多孔的结构有吸附性,只能吸附水中有异味和颜色的粒子,不能杀菌消毒,说法错误;D、为了保护水资源,应该科学地使用化肥和农药,不能禁止使用化肥和农药,说法错误。故选B。5. 剧烈运动后肌肉酸痛是部分葡萄糖(C6H12O6)转化成乳酸(C3H6O3)引起的,有关说法正确的是A. 葡萄糖(C6H12O6)中含有6个氧原子B. 葡萄糖(C6H12O6)中碳、氢、氧元素的质量比为1:2:1C. 乳酸(C3H6O3)在体内完全氧化的产物是CO和H2OD. 葡萄糖(C6H12O6)和乳酸(C3H6O3)中,氢元素的质量分数相等【答案】D【解析】【详解】A、根据葡萄糖(C6H12O6)化学式可知
16、,1个葡萄糖分子中含有6个氧原子,错误;B、葡萄糖中碳、氢、氧元素的质量比=(126):(112):(166)=6:1:8,错误;C、乳酸(C3H6O3)是由碳、氢、氧组成,在体内完全氧化的产物是CO2和H2O,错误;D、1个葡萄糖分子和1个乳酸分子中碳、氢、氧三种原子的个数比均为1:2:1,则葡萄糖和乳酸中氢元素的质量分数相同,正确。故选D。6. 高压臭氧除甲醛()反应的微观图示如下。有关说法正确的是A. 属于氧化物B. 反应I中,反应前后氧原子个数增加C. 反应II中,参加反应的反应物分子的个数比为1:1D. 整个过程中,O2可循环使用【答案】D【解析】【详解】A、由微粒图可知,由碳、氢、
17、氧三种原子构成,不属于氧化物,故选项说法错误;B、根据质量守恒定律,化学反应前后氧原子个数不变,所以反应I中反应前后氧原子个数不变,故选项说法错误;C、反应II,甲醛分子和臭氧分子在催化剂的催化作用下生成二氧化碳分子、水分子和氧分子,化学方程式为:,所以参加反应的反应物分子的个数比不是1:1,故选项说法错误;D、整个过程中,氧气是反应I的反应物,是反应II的生成物,氧气可循环使用,故选项说法正确。故选D。7. 下列陈述1与陈述II均正确,且具备因果关系的是选项陈述陈述A石墨具有导电性石墨常用作铅笔芯B厨余垃圾含N、P、K等元素厨余垃圾制花肥C铝的化学性质比铁活泼铝比铁更耐腐蚀D氢氧化钠能与酸反


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2023 广东省 深圳市 宝安区 中考 化学 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-242568.html