 2023年广东省广州市天河区中考二模化学试卷(含答案)
2023年广东省广州市天河区中考二模化学试卷(含答案)
《2023年广东省广州市天河区中考二模化学试卷(含答案)》由会员分享,可在线阅读,更多相关《2023年广东省广州市天河区中考二模化学试卷(含答案)(9页珍藏版)》请在七七文库上搜索。
1、2023年广东省广州市天河区中考二模化学试卷相对原子质量: H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Ca-40 Cu-64一、选择题:本题包括 14 小题,每小题3 分,共 42分。1. 下列古代技术中涉及化学变化的是A、谷物酿酒 B、手工织布 C、海水晒盐 D、水车灌溉2. 锌猛干电池所用材料如图。下列说法不正确的是A、 该电池体现了石墨、锌的导电性 B、 黄铜(锌铜合金)的硬度比铜大C、 塑料属于有机合成材料 D、 二氧化锰属于金属材料3. 下列制作饼干的原料中富含油脂的是A、精炼植物油 B、小麦粉 C、白砂糖 D、鲜鸡蛋4. 提高安全意识,规避风险。下
2、列做法正确的是A、将水加入浓硫酸中配制稀硫酸B、燃气泄漏,立刻打开排气扇的电源开关C、面粉加工厂、纺织厂标有“严禁烟火”字样或图标D、烧碱溶液不慎沾到皮肤上,立即用大量水冲洗,再涂上碳酸氢钠溶液5. 硒是人体必需的微量元素,其在元素周期表中的信息和原子结构示意图如图。下列说法正确的是A、硒原子在化学反应中易得到电子变成Se2+ B、硒原子的核外电子分 4 层排布C、硒的相对原子质量为 78.96g D、硒属于金属元素6. 下列有关水的说法不正确的是A、通过蒸馏可以降低水的硬度 B、明矶用于自来水杀菌、消毒C、水能溶解很多物质,是一种最常用的溶剂 D、软水和硬水可用肥皂水区分,产生泡沫多的是软水
3、7. 20182020 年我国电力能源结构如图。下列说法不正确的是A、 化石燃料燃烧产生热能 B、发电量占比:火电水电风电核电C、水能、风能属于清洁能源 D、大力发展燃煤火力发电能减少碳排放8. 工业上用 CH4和 CO2制取合成气会产生积碳,如图是抗积碳示意图。下列说法不正确的是A、该反应过程中涉及分解反应、化合反应B、该反应前后元素种类不变,原子数目发生变化C、该反应前后 Ni 基双金属催化剂的质量没有发生变化D、该反应有利于减缓温室效应9. 定期进行场所消毒有利于保障人体健康。下列有关消毒剂的说法正确的是A、醋酸 (CH3COOH) 由 2 个碳原子、4 个原子和 2 个氧原子构成B、次
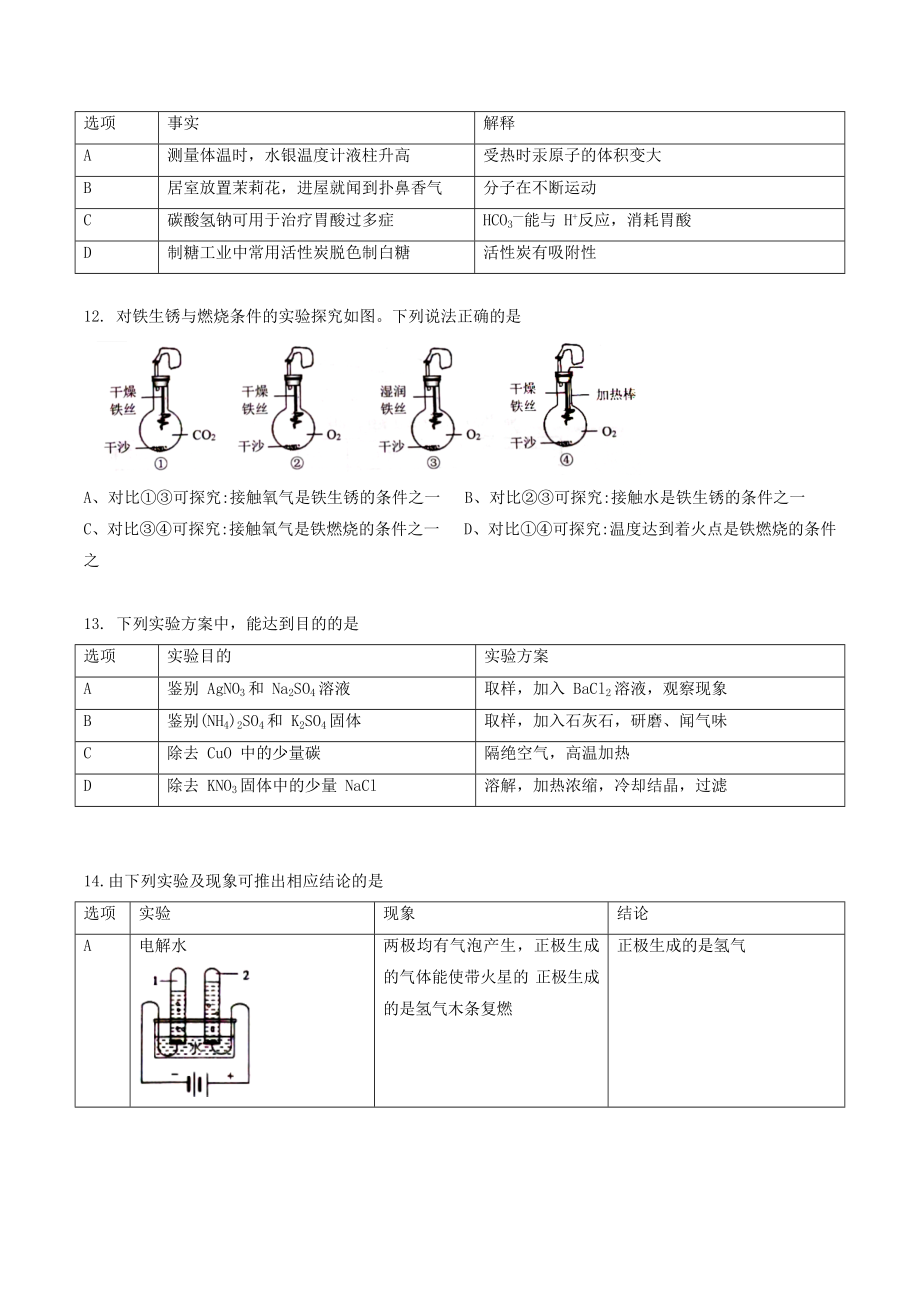
4、氯酸钠卡(NaClO)中氯元素的化合价为-1价C、正丙醇(C3H8O) 中碳、氢、氧三种元素的质量比为3:8:1D、过氧乙酸(C2H4O3) 中氢元素的质量分数最小10. 以 N2和 H2O为原料,基于 LDH(一种固体催化剂) 合成气 (NH3),其原理如图。下列说法正确的是A、该反应的化学方程式为3N2+6H2O LDH=光照 4NH3+3H2O2 B、该反应中各元素的化合价均发生了变化C、该反应消耗的水与生成的氨气的质量比为 27 :17 D、产物通过氨分离器得到液氨和氧气,分离原理是过滤11. 对下列事实的解释不正确的是选项事实解释A测量体温时,水银温度计液柱升高受热时汞原子的体积变大
5、B居室放置茉莉花,进屋就闻到扑鼻香气分子在不断运动C碳酸氢钠可用于治疗胃酸过多症HCO3能与 H+反应,消耗胃酸D制糖工业中常用活性炭脱色制白糖活性炭有吸附性12. 对铁生锈与燃烧条件的实验探究如图。下列说法正确的是A、对比可探究:接触氧气是铁生锈的条件之一 B、对比可探究:接触水是铁生锈的条件之一C、对比可探究:接触氧气是铁燃烧的条件之一 D、对比可探究:温度达到着火点是铁燃烧的条件之13. 下列实验方案中,能达到目的的是选项实验目的实验方案A鉴别 AgNO3和 Na2SO4溶液取样,加入 BaCl2溶液,观察现象B鉴别(NH4)2SO4和 K2SO4固体取样,加入石灰石,研磨、闻气味C除去
6、 CuO 中的少量碳隔绝空气,高温加热D除去 KNO3固体中的少量 NaCl溶解,加热浓缩,冷却结晶,过滤14.由下列实验及现象可推出相应结论的是选项实验现象结论A电解水两极均有气泡产生,正极生成的气体能使带火星的 正极生成的是氢气木条复燃正极生成的是氢气B澄清石灰水变浑浊甲烷中含有碳元素和氢元素CCa(OH)2的性质实验试管 a 中溶液红色、浊试管 b 中溶液无色、澄清Ca(OH)2微溶于水,能溶于盐酸,其水溶液呈碱性DU型管中红墨水左低右高生石灰与水反应吸收大量的热二、 非选择题:本题包括6 小题,共 48 分(6 分) 15 .海洋是一个巨大的资源宝库。(1) 海洋中的可食用鱼类可以为人
7、类提供所需的主要营养物质是 。(2) 2022 年我国科研团队通过全新原理实现海水直接电解制氢。海水属于 (填“纯净物”或“混合物”),电解水制氢气是 将能转化为化学能。(3)海水等天然水中微生物使有机物人以 (C6H10O5表示,相对分子质量为 162)转化为CO2和H2O的过程所需O2的量叫做生化需氧量 (BOD,单位为 mg/L),反应的化学方程式为:C6H10O5 + 6O2 微生物= 6CO2 + 5H2O20时,测得 1L 某水样中条有C6H10O5的质量为 8.1 mg,则该水样的 BOD 值是 mg/L。(4) 南海发现有成片的矿产资源铁锰结核 (主要成分为铁锰氧化物)。锰单质
8、可由MnO2与 Al在高温下发生置换反应制得,该反应的化学方程式为 。16. (6 分) 空气是一种宝贵的自然资源。(1) 正常雨水的 pH5.6 的原因是溶解 (填化学式)(2)下列说法不正确的是 (填标号)。A、实验室常采用加热 KMnO4、分解 H2O2的方法制取 O2B、硫在空气中燃烧,发出蓝紫色火焰C、增大燃料与空气的接触面,能使燃料充分燃烧D、N2的化学性质不活泼,不能与任何物质发生反应(3) 空气中常见的污染物有 CO、SO2、NO2等。写出 CO2 的一种常见用途: 。SO2可用 Na2CO3溶液吸收,反应过程中溶液组成变化如图。吸收初期(A 点以前) 反应的化学方程式为 。不


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2023 广东省 广州市 天河 中考 化学 试卷 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-242565.html