 第三章《水溶液中的离子反应与平衡》测试题(含答案)2022-2023学年高二人教版(2019)化学选择性必修1
第三章《水溶液中的离子反应与平衡》测试题(含答案)2022-2023学年高二人教版(2019)化学选择性必修1
《第三章《水溶液中的离子反应与平衡》测试题(含答案)2022-2023学年高二人教版(2019)化学选择性必修1》由会员分享,可在线阅读,更多相关《第三章《水溶液中的离子反应与平衡》测试题(含答案)2022-2023学年高二人教版(2019)化学选择性必修1(20页珍藏版)》请在七七文库上搜索。
1、第三章水溶液中的离子反应与平衡一、单选题(共12题)1一定温度下,将浓度为溶液加水不断稀释,始终保持增大的是ABCD2下列各组离子一定能大量共存的组合是在含有大量Al(OH)4-溶液中:NH、Na+、Cl-、HCO常温下c(H+)=10-12molL-1的溶液:K+、Ba2+、Cl-、Br-常温下pH=7的溶液中:Na+、Cl-、SO、Fe3+在水溶液中:K+、SO、Cu2+、NO常温下c(OH-)=10-12molL-1的溶液:K+、Al3+、Cl-、SO常温下pH=1的溶液中:K+、CrO、Na+、SOABCD3下列事实与盐类水解无关的是A长期施用铵态氮肥会使土壤酸化B配制 FeSO4溶液
2、时,加入一定量 Fe 粉C明矾可以作为净水剂D碳酸钠的酚酞溶液中滴加氯化钡溶液,红色变浅4下列指定反应的离子方程式不正确的是AFeO溶于稀硝酸:3FeO+10H+NO=3Fe3+NO+5H2OBKMnO4与浓盐酸反应制氯气:16H+10Cl-+2MnO=2Mn2+5Cl2+8H2OC向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+D向NaHCO3溶液中滴加少量Ba(OH)2溶液:HCO+Ba2+OH-=BaCO3+H2O5某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关
3、数据如下表:滴定次数待测氢氧化钠溶液的体积/mL0.1000mol/L盐酸的体积/mL滴定前刻度滴定后刻度第一次25.000.0027.45第二次25.000.0030.30第三次25.000.0017.55下列说法正确的是A该氢氧化钠溶液中c(NaOH)=0.1155mol/LB当溶液从无色刚好变成红色时,则达到滴定终点C达滴定终点时,滴定管尖嘴有悬液,则测定结果偏低D实验中锥形瓶应用待测氢氧化钠溶液润洗6下列溶液,在空气中受热浓缩,能够得到预想的无水盐的是AMgSO4溶液MgSO4BFeCl3溶液FeCl3CMg(NO3)2溶液Mg(NO3)2DAlCl3溶液AlCl37时有三瓶溶液:的盐
4、酸、的醋酸溶液和的氢氧化钠溶液,下列说法正确的是A中和等体积的的氢氧化钠溶液,所需的醋酸溶液的体积大于的盐酸的体积B往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全C将上述盐酸溶液和醋酸溶液等体积混合,混合后溶液的D时,的盐酸、的醋酸溶液中水电离出的均为8下列溶液:CH3COOH HCl NaOH CH3COONa KCl NH4Cl其物质的量浓度均为0.1mol/L,其pH由大到小排列顺序为ABCD9酸碱中和滴定常用于测定酸或碱的浓度。实验小组用0.1000 molL1的NaOH溶液滴定20.00 mL 0.1000 molL1的CH3COOH溶液。下列情况会造成所滴加N
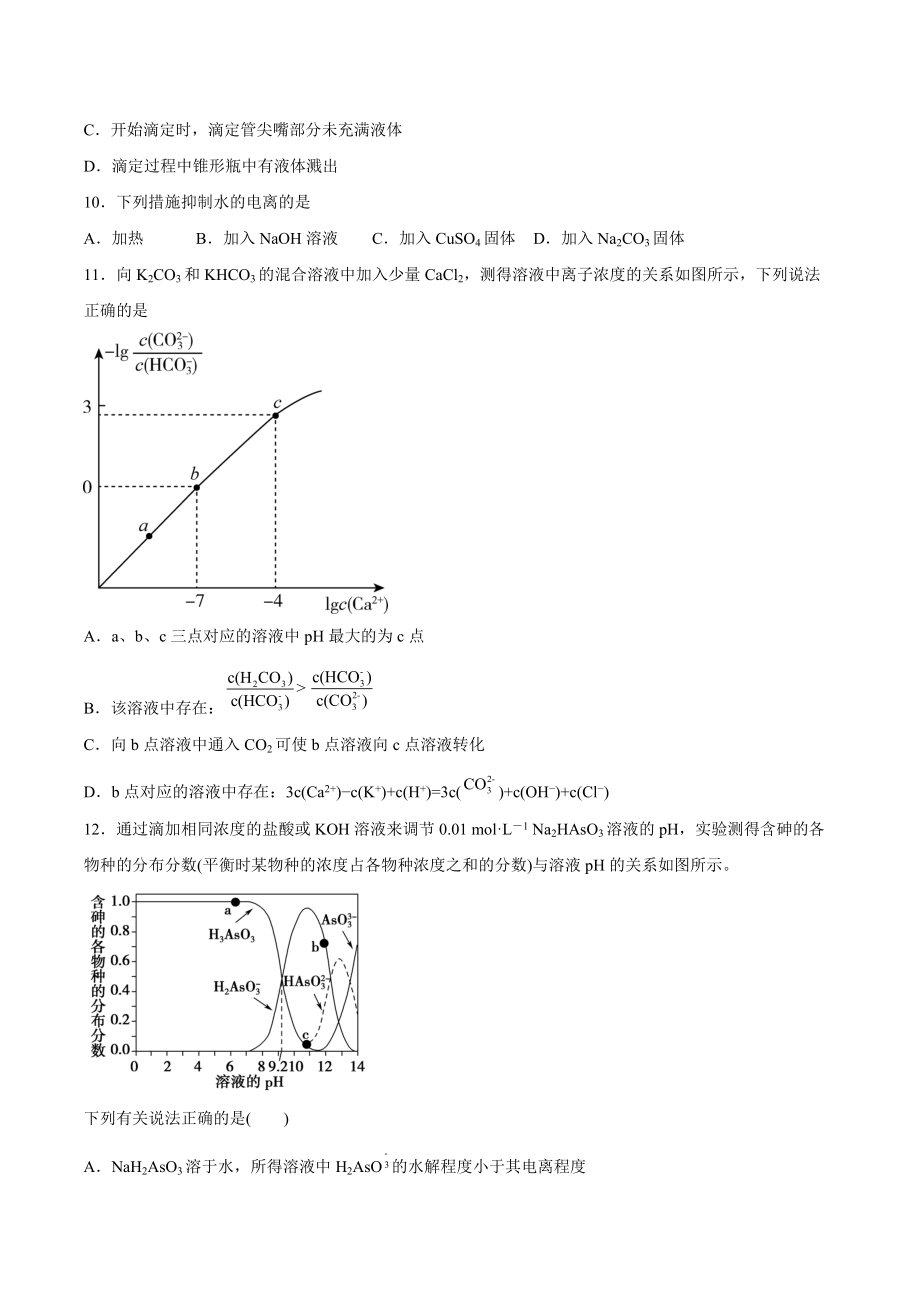
5、aOH溶液体积偏小的是A盛装CH3COOH溶液的锥形瓶水洗后未干燥B装NaOH溶液的滴定管水洗后未润洗C开始滴定时,滴定管尖嘴部分未充满液体D滴定过程中锥形瓶中有液体溅出10下列措施抑制水的电离的是A加热B加入NaOH溶液C加入CuSO4固体D加入Na2CO3固体11向K2CO3和KHCO3的混合溶液中加入少量CaCl2,测得溶液中离子浓度的关系如图所示,下列说法正确的是Aa、b、c三点对应的溶液中pH最大的为c点B该溶液中存在:C向b点溶液中通入CO2可使b点溶液向c点溶液转化Db点对应的溶液中存在:3c(Ca2+)c(K+)+c(H+)=3c()+c(OH)+c(Cl)12通过滴加相同浓度
6、的盐酸或KOH溶液来调节0.01 molL1 Na2HAsO3溶液的pH,实验测得含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示。下列有关说法正确的是()ANaH2AsO3溶于水,所得溶液中H2AsO的水解程度小于其电离程度BK1(H3AsO3)的数量级为109C水的电离程度:a点大于b点Dc点溶液中存在:c(Na)2c(H2AsO)4c(HAsO)2c(AsO)二、非选择题(共10题)13盐碱地(含较多的NaCl、)不利于农作物生长,通过施加适量石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因_,以及用石膏降低其碱性的反应原理_。14已
7、知25时,几种常见弱酸的Ka如下表所示:电解质H2C2O4CH3COOHHCNH2CO3电离常数K1=5.610-2K2=5.410-3K=1.710-5K=6.210-10K1=4.210-7K2=5.610-11(1)25时,0.1molL-1的Na2C2O4CH3COONaNaCNNa2CO3溶液的pH由大到小的顺序是_。(2)KHC2O4溶液呈酸性,向10mL0.01molL-1的H2C2O4溶液滴加0.01molL-1KOH溶液V(mL)。回答下列问题:当V10mL时,反应的离子方程式为_。当V=10mL时,溶液中、H2C2O4、H+的浓度由大到小的顺序为_。当V=amL时,溶液中离
8、子浓度有如下关系:c(K+)=2c()+c();当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c()+c()+c(H2C2O4);则a_b(填“”“=”或“”)。15完成下列填空(1)常温下,已知0.1mol/L一元酸HA溶液中。常温下,0.1mol/LHA溶液的pH=_;pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_;0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合后所得溶液呈_性;用离子方程式表示原因_(2)t时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=_。
9、该温度下(t),将100mL 0.1mol/L的稀溶液与100mL 0.4mol/L的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=_。(3)已知碳酸、亚硫酸、次氯酸的电离平衡常数如下表,下列说法正确的是_物质HClO电离平衡常数Ka1Ka2A相同条件下,同浓度的NaClO溶液和溶液的碱性,前者更强B溶液中通入少量:C溶液中通入少量:D向氯水中分别加入等浓度的和溶液,均可提高氯水中HClO的浓度(4)联氨(又称联肼,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_(已知:的;)。联氨与硫酸
10、形成的酸式盐的化学式为_。16已知水在25和95时的电离平衡曲线如图所示。(1)25时水的电离平衡曲线应为_(填“A”或“B”)。请说明理由_。25时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_。(2)95时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是_。(3)在曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用1、2表示,则1_2(填“大于”“小于”“等于”“无法确定”,下同),若将二者等体积混合,则混合液的
11、pH_7,判断的理由是_。(4)在曲线B所对应的温度下,将0.02molL-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=_。17次氯酸具有强氧化性,能起到杀菌消毒的作用。实验室制备的反应原理为,其制备装置如图所示,E中得到次氯酸。回答下列问题:己知:气体时可分解,且可与水反应生成;是难溶于水的固体。(1)仪器a的名称是_。写出装置A中反应的离子方程式_。(2)装置B的作用是_,装置C中盛装的试剂是_。(3)D中通入与反应制得,则E中生成的化学反应方程式为_。(4)有效含氯量常用来衡量消毒剂的消毒能力,用标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实
12、验步骤如下:称取含氯消毒片,用容量瓶配制成溶液,定容时,用_加蒸馏水至刻度线;配置溶液及浓度标定:称取晶体于烧杯中,取蒸馏水溶解均匀,转入_色试剂瓶中,置于暗处放置714天后,用酸性标准溶液标定上述溶液的浓度为;用滴定管量取待测消毒溶液,置于碘量瓶中,加入的硫酸,10%碘化钾溶液,此时溶液出现棕色,用溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入12滴10%淀粉指示剂,继续滴定至_即为终点。记录消耗的溶液的体积;重复上述操作三次。四次测定的数据如下表:实验序号1234消耗溶液的体积/20.0520.0019.9520.45根据溶液的用量,计算消毒片的有效氯含量,已知的硫代硫酸钠相当于有效
13、氯,则该市售含氯消毒片的有效氯含量为_%。18在水的电离平衡中,c(H+)和c(OH)的关系如图所示:(1)A点水的离子积为11014mol2/L2,B点水的离子积为_.造成水的离子积变化的原因是_。(2)100时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_;_.(3)100时,若盐酸中c(H+)=5104mol/L,则由水电离产生的c(H+)是_19高锰酸钾纯度的测定:称取1.080 0 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 molL1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48
14、mL,该样品的纯度为_(列出计算式即可,已知2MnO5H2C2O46H=2Mn210CO28H2O)。20硫化锂(Li2S)易潮解,在加热条件下易被空气中的氧化,是一种潜在的锂电池的电解质材料。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备,并用制得的去还原硫酸锂制备硫化锂,反应原理:,实验装置如图所示。请回答下列问题:(1)选择A装置实现随制随停,还适用于下列试剂制备对应气体的是_(填标号)。a.70%硫酸、亚硫酸钠b.:稀盐酸、大理石c.:浓氨水、生石灰d.:浓盐酸、(2)C和E装置中盛装的试剂相同,均可选择_(填名称),E装置的作用是_。(3)B装置中发生反应的离子方程式为_。(4)得
15、到的产品中往往含有一定量的杂质,某小组同学对产品中的杂质进行探究。提出猜想:猜想一:产品中含杂质猜想二:产品中含杂质猜想三:产品中含杂质S依据所学知识,猜想三不成立,理由是_。化学小组为验证猜想:限选试剂:稀盐酸、稀硫酸、蒸馏水、品红溶液、双氧水、氯化钡溶液、硝酸钡溶液实验操作与现象结论I取少量样品溶于水,_样品中不含II在实验I反应后的溶液中,_样品中含(5)测定产品纯度的方法:取wg样品加入足量稀硫酸,充分反应后,煮沸溶液,冷却后滴加酚酞溶液作指示剂,用NaOH标准溶液滴定,消耗NaOH标准溶液。煮沸的目的是_。样品的纯度为_。21回答下列问题:(1)立德粉ZnSBaSO4中S2-的含量可
16、以用“碘量法”测得。称取mg立德粉,置于碘量瓶中,移取25.00mL0.1000molL-1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000molL-1Na2S2O3溶液滴定,反应式为I2+2S2O=2I-+S4O。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为_,样品中S2-的含量为_(写出表达式)。(2)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,用0.01000molL-1的碘标准液滴定至终点,消耗10.00mL。滴定反应的离子方程式为_,该样品中Na
17、2S2O5的残留量为_gL-1(以SO2计)。22某兴趣小组对化合物X开展探究实验。其中:X由5种短周期主族元素组成;B在标况下的密度为;A的焰色反应是紫色;所有物质都是纯净物。(气体体积已折算为标况下的体积)请回答:(1)组成X的元素除了Na、O外还有_(填元素符号),X的化学式是_。(2)X与发生的反应的化学方程式是_。(3)少量C与足量反应也产生G,该反应的离子方程式是_。(4),F、H的阴离子相同,反应后所得溶液呈酸性,原因是_。(5)已知C与A加热可制备得到一种气体,请设计实验探究该气体的组成:_(已知该气体只有两种元素组成)。参考答案:1DAHF为弱酸,存在电离平衡:加水稀释,平衡
18、正向移动,但c()减小,故A不符合题意; B电离平衡常数只受温度的影响,温度不变,电离平衡常数Ka(HF)不变,故B不符合题意;C当溶液无限稀释时,不断减小,无限接近,减小,故C不符合题意;D由于加水稀释,平衡正向移动,所以溶液中增大,减小,增大,故D符合题意;故答案为D。2BAl(OH)4-与、HCO发生双水解反应而不能大量共存,故不符合题意;常温下c(H+)=10-12molL-1的溶液呈碱性,K+、Ba2+、Cl-、Br-能大量共存,故符合题意;常温下pH=7的溶液与Fe3+不能共存,故不符合题意;在水溶液中:K+、SO、Cu2+、NO能大量共存,故符合题意;常温下c(OH-)=10-1
19、2molL-1的溶液呈酸性,K+、Al3+、Cl-、SO能大量共存,故符合题意;常温下pH=1的溶液H+与CrO不能共存,故不符合题意;故符合题意的有,故选:B。3BA 铵根离子水解,生成氢离子,则长期施用铵态氮肥会使土壤酸化,故A不符合;B 配制 FeSO4溶液时,加入一定量 Fe 粉,可防止Fe2+被氧化生成Fe3+,与盐类水解无关,故B符合;C 铝离子水解,生成的氢氧化铝胶体具有吸附性,能吸附水中悬浮的杂质沉降净水,故明矾可以作为净水剂,故C不符合;D 碳酸钠溶液中碳酸根离子水解,使溶液显碱性,则碳酸钠的酚酞溶液呈红色,滴加氯化钡溶液,钡离子与碳酸根离子结合生成碳酸钡沉淀,碳酸根离子浓度
20、减小,平衡逆向移动,氢氧根离子浓度碱小,碱性减弱,则红色变浅,故D不符合;故选B。4DAFeO溶于稀硝酸的离子方程式为:3FeO+10H+NO=3Fe3+NO+5H2O,A正确;BKMnO4与浓盐酸反应制氯气的离子方程式为:16H+10Cl-+2MnO=2Mn2+5Cl2+8H2O,B正确;C向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀发生沉淀转化,反应的离子方程式为:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+,C正确;D向NaHCO3溶液中滴加少量Ba(OH)2溶液的离子方程式为:2HCO+Ba2+2OH-=BaCO3+2H2O+,D错误;故答案为D。5A第三
21、次实验数据偏离正常误差,舍去,第一次和第二次实验平均消耗盐酸的体积应该求两次实验的平均值,误差分析需要根据c(NaOH)V(NaOH)c(HCl)V(HCl)进行分析。A第三次实验数据偏离正常误差,舍去,第一次和第二次实验平均消耗盐酸的体积是28.8750mL,根据该氢氧化钠溶液中c(NaOH)V(NaOH)c(HCl)V(HCl),c(NaOH)=0.1155 molL-1,故A正确;B盐酸滴定氢氧化钠时,酚酞遇氢氧化钠显红色,当溶液从红色变成无色,且半分钟内不褪色,则达到滴定终点,故B错误;C滴定达终点时,滴定管尖嘴有悬液,消耗酸的体积偏大,则测定结果偏高,故C错误;D锥形瓶若用待测氢氧化


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 水溶液中的离子反应与平衡 第三 水溶液 中的 离子 反应 平衡 测试 答案 2022 2023 学年 高二人教版 2019 化学 选择性 必修
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-223640.html