 2022年江苏省常州市金坛区中考二模化学试卷(含答案解析)
2022年江苏省常州市金坛区中考二模化学试卷(含答案解析)
《2022年江苏省常州市金坛区中考二模化学试卷(含答案解析)》由会员分享,可在线阅读,更多相关《2022年江苏省常州市金坛区中考二模化学试卷(含答案解析)(32页珍藏版)》请在七七文库上搜索。
1、20222022 年江苏省常州市金坛区中考二模化学试题年江苏省常州市金坛区中考二模化学试题 一、选择题一、选择题(本题包括本题包括 20 小题,每小题小题,每小题 2 分,共分,共 40 分分) 1. 下列物质的使用过程主要发生化学变化的是 A. 活性炭除色 B. 分离液态空气 C. 金属铝氧化 D. 氢氧化钠潮解 2. 碳酸氢钠的俗名是 A. 烧碱 B. 纯碱 C. 小苏打 D. 熟石灰 3. 下列属于空气质量报告中需要监测的污染物是 A. 二氧化碳 B. 氮气 C. 二氧化硫 D. 水蒸气 4. 下列常用调味品中,与水充分混合后不能形成溶液的是 A. 砂糖 B. 食盐 C. 白醋 D. 芝
2、麻油 5. 下列有关粗盐提纯实验中的相关装置和操作,正确的是 A. 溶解粗盐 B. 过滤食盐水 C. 蒸发食盐水 D. 冷却蒸发皿 6. 下列人体所缺元素与引起的健康问题关系正确的是 A. 缺铁会引起贫血 B. 碘过量会引起龋齿 C 缺锌会导致甲状腺疾病 D. 缺钙会引起坏血病 7. 下列对历史上几项重要研究成果介绍错误的是 A. 波义耳发现了质量守恒定律 B. 张青莲精确测定了铈的相对原子质量 C. 门捷列夫发表了元素周期表 D. 侯德榜创新了制碱法 8. 能源是为人类提供所需能量的资源。下列属于可再生能源的是 A. 煤 B. 石油 C. 天然气 D. 风能 9. 下列归类正确的是 A. 有
3、机物:碳酸、酒精、甲烷 B. 常见合金:紫铜、黄铜、青铜 C. 复合肥:草木灰、硝酸钾、碳铵 D. 合成材料:涤纶、腈纶、有机玻璃 10. 下列对实验现象的描述或实验操作正确的是 A. 细铁丝在空气中剧烈燃烧,火星四射 B. 饱和澄清石灰水升温后会变浑浊 C. 鸡蛋清中滴加饱和硫酸铵溶液,出现黄色固体 D. 硫在空气中燃烧发出蓝紫色火焰,生成有刺激性气味的气体 11. 以甲醇为原料的一款新型手机电池,其反应原理为:2CH3OH3X4NaOH=2Na2CO36H2O,其中 X的化学式为( )。 A. CO B. CO2 C. O2 D. H2 阅读下列材料,完成下列小题:2021年 10 月 1
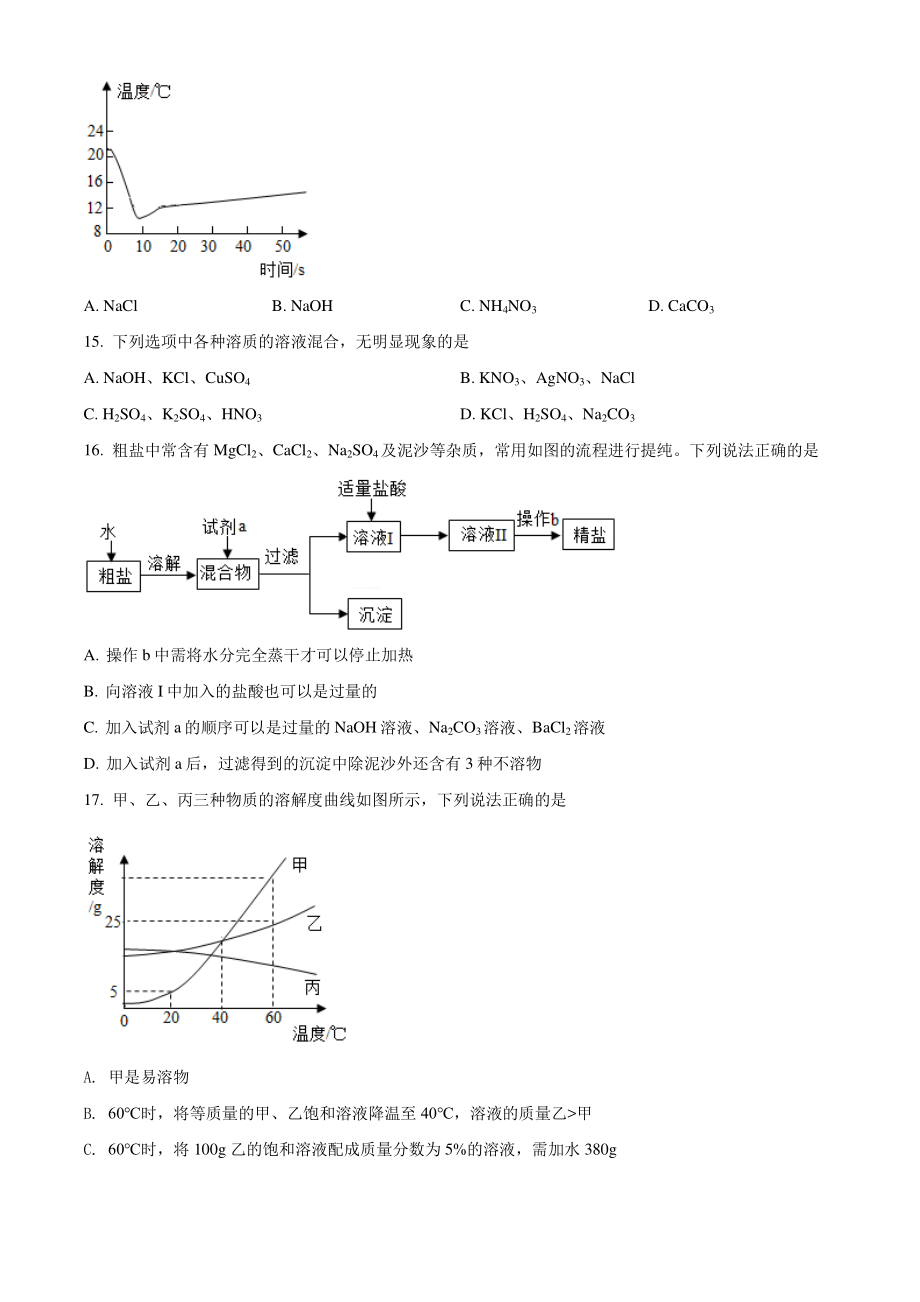
4、6日,神舟十三号载人飞船发射成功,三名航天员协同配合,圆满完成中国空间站出舱活动。 12. 神舟十二号飞船上使用的国产 CPU芯片是由高纯度单品硅为原料生产的,结合“题图”,下列说法正确的是 A. 硅元素属于金属元素 B. 硅原子核内有 14个质子 C. 硅原子核外有 4 个电子 D. 硅的相对原子质量为 28.09g 13. 飞船上燃料发生化学反应微观示意图如图所示,下列说法正确的是 A. 化学反应前后原子的种类发生改变 B. 参加反应的甲、丁分子个数比为 1:1 C. 乙中两种元素的质量比为 1:2 D. 反应生成的丙和丁的质量比为 7:6 14. 取某固体物质 5g 加入 20mL 水中
5、,测得溶液的温度随时间变化曲线如图所示。该固体物质可能是 A. NaCl B. NaOH C. NH4NO3 D. CaCO3 15. 下列选项中各种溶质的溶液混合,无明显现象的是 A. NaOH、KCl、CuSO4 B. KNO3、AgNO3、NaCl C. H2SO4、K2SO4、HNO3 D. KCl、H2SO4、Na2CO3 16. 粗盐中常含有 MgCl2、CaCl2、Na2SO4及泥沙等杂质,常用如图的流程进行提纯。下列说法正确的是 A. 操作 b 中需将水分完全蒸干才可以停止加热 B. 向溶液 I中加入的盐酸也可以是过量的 C. 加入试剂 a的顺序可以是过量的 NaOH溶液、Na
6、2CO3溶液、BaCl2溶液 D. 加入试剂 a 后,过滤得到的沉淀中除泥沙外还含有 3种不溶物 17. 甲、乙、丙三种物质的溶解度曲线如图所示,下列说法正确的是 A. 甲是易溶物 B. 60时,将等质量的甲、乙饱和溶液降温至 40,溶液的质量乙甲 C. 60时,将 100g 乙的饱和溶液配成质量分数为 5%的溶液,需加水 380g D. 甲中混有少量丙,若要得到较纯净的甲,常采用蒸发结晶的方法 18. 对于如图的反应:A+BC+D,下列说法正确的是 A. 若 C 为金属单质,D为 CO2,则该反应一定是置换反应 B. 若 C 为一种盐,D为 H2O,A为酸,则 B一定是一种碱 C. 若 C
7、为3 2Cu(NO ),A为 AgNO3,则 B一定是 Cu,D 一定是 Ag D. 若 C为 CO2,D为 H2O,B 为 O2,则 A中一定含有 C、H元素 19. 将一定质量的锌粉加入到 Cu(NO3)2、AgNO3两种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是 A. 若滤液为蓝色,则滤渣中一定有银和铜 B. 若滤液为无色,则滤渣中一定有银和锌,可能含有铜 C. 若向滤液中加入稀盐酸有白色沉淀生成,则原滤液中溶质只有 AgNO3和 Zn(NO3)2 D. 若向滤渣中加入稀盐酸有气泡产生,则滤液中溶质只有 Zn(NO3)2 20. 在一个密闭容器中,有 a、b、
8、c、d 四种物质,反应前各物质的质量关系如下图刻度纸所示(例如:d的质量为 2g) 。 在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线向右移动 9 格;刻度线向左移动 8 格;刻度线向左移动 8 格。下列说法正确的是 A. 反应结束后 c 的质量为 14g B. 该反应可能置换反应 C. a、b 变化的质量比一定为 9:17 D. a、d 的相对分子质量之比一定为 9:8 二、填空题二、填空题(本大题共本大题共 4 小题,共小题,共 20 分分) 21. 人类的衣、食、住、行都离不开化学,从所给的物质中选择一种填空(填序号):
9、 氯化钠氮气熟石灰赤铁矿盐酸 (1)常用的食品调味剂是_。 (2)工业上高炉炼铁的原料之一是_。 (3)能用作食物保护气的是_。 (4)农业上改良酸性土壤的是_。 (5)人体中胃液中的酸_。 22. 在抗击新冠肺炎的过程中,测体温、戴口罩、勤消毒等是必需的防疫措施。 (1)水银体温计中的汞是由_直接构成; (2)戴口罩能有效阻隔可吸入颗粒物、细菌等,其原理与化学实验中的_基本操作类似。 (3)免洗手消毒液中含有的酒精,可使细菌中的蛋白质_达到消毒目的;酒精使用时应远离火种,酒精不慎泼洒燃烧,灭火的方法是_。 23. 北京冬类会于 2022年 2 月 4日开幕,本次奥运会体现艺术与科技的完美融合
10、。 (1)神奇的制冰技术:将二氧化碳气体在一定条件下转变成超临界二氧化碳流体,从而实现制冷制冰的过程。从微观的角度分析,该转化中的实质是_;从环保角度分析,该技术有利于解决_。 (2)神奇的服装材料:本次冬奥会服装中添加的第二代石墨烯发热材料,石墨烯与金刚石都是碳的单质,但物理性质差异很大。其原因是_。 (3)神奇的冬奥火炬:火炬采用氢气做燃料,体现了绿色奥运的理念,从而能实现“零排放”的原因:_(用化学方程式解释)。火炬外壳采用质轻的耐高温碳纤维材料。测得碳纤维强度与热处理温度的关系如图:由如图可知碳纤维强度与热处理温度的关系是_。 24. 空气是宝贵的自然资源,以空气为原料可以制造许多物质
11、。 (1)1909年,哈伯将氮气和氢气在高温、高压以及催化剂条件下首次合成氨气,NH3中氮元素的化合价为_。 (2)科学家研制出“TM-LiH”双催化剂体系,显著提高在温和条件下氮气和氢气合成氨的效率,原理如图:该反应中变化的微粒有_(填化学符号)。 (3)将二氧化碳和氮气在一定条件下反应制取尿素【CO(NH2)2】 ,该反应的化学方程式_。 (4)中国科学家首次利用二氧化碳人工合成淀粉【(C6H10O5)n】 ,二氧化碳到淀粉的合成过程中必须添加的元素是_(填化学符号)。 三、实验探究题三、实验探究题(本题包括本题包括 5 小题,共小题,共 40 分分) 25. 实验室常用高锰酸钾制取氧气,
12、可能用到的装置如图所示。 (1)仪器的名称_。 (2)用上述药品为原料制取一瓶用于铁丝燃烧实验的氧气,较合适的装置组合为_(填字母); (3)写出高锰酸钾分解制氧气的化学方程式_。该反应的理论产氧率为_【产氧率=氧气高锰酸钾m100%m ,结果精确到 0.1%】 (4)某同学进行该实验并用排水法收集 O2,下列操作可能导致氧气不纯净的是_。 a加入高锰酸钾固体前先检查装置气密性 b当导管口有气泡冒出时,开始收集氧气 c集气瓶中未装满水就开始收集 d气体收集完毕后,先熄灭酒精灯,再将导管移出水面 (5)实验室也可用双氧水制氧气。某同学采用 68g质量分数为 10%的双氧水溶液和一定质量的 MnO
13、2粉末混合,最多可制取_g 氧气(写出计算过程,结果保留一位小数)。 26. 兴趣小组的同学借助 pH传感器监测溶液 pH的变化情况来探究稀盐酸和氢氧化钠溶液的反应,请根据反应过程中溶液的 pH变化曲线图回答下列问题。 (1)向锥形瓶中缓慢滴入稀盐酸,能说明稀盐酸与氢氧化钠溶液发生化学反应的现象是_,写出反应的化学方程式_,此反应属于_(填基本反应类型)。 (2)曲线上的 m点对应的溶液中含有的离子_(写化学符号)。 (3)下列说法是同学们在分析实验过程中数据时得出的结论,你认为正确的是_(填字母)。 a.氢氧化钠的质量不断变小直至为 0 b.使用磁力搅拌器的目的是吸收热量 c.氯化钠的质量分
14、数一直在不断增大 d.也可以选用 pH试纸验证反应的发生 27. 实验室制取的二氧化碳中常混有氯化氢气体,用排饱和碳酸氢钠溶液可以除去,用排水的方法是否也可以除去呢? 实验 1:排水法与排饱和碳酸氢钠法除氯化氢效果的比较 用 26%的浓盐酸制取二氧化碳,分别用向上排空气法、排水法、排饱和碳酸氢钠溶液法收集 250ml二氧化碳,再各自加入 20ml10%的氢氧化钠溶液吸收,再加入 10ml18%硝酸溶液调节 pH,用氯离子传感器测定氯离子含量。相关数据如图、表 1 所示: 1 2 3 三次平均 排空集气法 23.3 20.2 46.6 29.9 排水法 3.1 3.5 3.7 3.4 排饱和碳酸
15、氢钠法 2 6 3.2 3.0 2.9 (1)根据表 1 内容,图 10 中曲线_(a、b、c)表示的是排空气法收集的二氧化碳。 (2)根据实验 1 相关数据可知,实验室若要收集最纯净的二氧化碳气体,应选用_(排水法排饱和碳酸氢钠法、两种均可以),理由是_ 。 实验 2:排水法与排饱和碳酸氢钠溶液法收集二氧化碳纯度的比较 在 18下,用碳酸钠粉末和稀硫酸制取二氧化碳,分别用上述两种方法收集两瓶 250mL的二氧化碳,再各加入 20mL10%氢氧化钠溶液,振荡,用压强传感器测定出最终压强如表 2。 排水法 排饱和碳酸氢钠溶液法 三次实验所测压强/kpa 1 7.22 6.77 2 7.10 6.
16、77 3 6.90 7.02 平均/kpa 7.07 6.82 已知:实验初始压强为 104.40kPa,二氧化碳的纯度计算式为:(实验最终压强1-实验初始压强) 100% (3)结合表 2 数据和资料可知:两种方法收集的二氧化碳纯度差值为:_(保留 0.1%) 28. 化学兴趣小组的同学对水进行了探究,结合材料分析下列问题。 探究 I:水的性质 【史料回顾】化学家拉瓦锡在研究水的组成实验时(如图),将水蒸气通过红热的铁管(EF)。 未反应的水蒸气经过 S冷凝成液态,流入容器 H,产生的气体在 K处收集后,经检验证实是氢气,此外还得到一种固体。 【猜想与假设】同学们认为该固体可能是“铁的一种氧
17、化物”,还可能含有“过量的铁”,并模拟上述实验进行如下探究。 【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4),其中 FeO 接触到空气会立即由黑色变为红棕色,铁的三种氧化物都不与硫酸铜溶液反应 【实验探究】 实验步骤 实验现象 实验结论 倒出上述反应后的黑色固体,平铺于白纸上 黑色固体不变色 黑色固体中一定没有_(填物质名称) 取上述黑色固体少许,装入试管,加入足量_溶液 _,且有红色固体出现 黑色固体中一定含有 Fe 和 Fe3O3 【得出结论】结合以上实验和资料可知,铁与水蒸气发生反应的化学方程式是_。 探究:水的用途 将水蒸气和空气按一定比例吹入煤气发生炉中与炽热的无烟煤作
18、用产生半水煤气(主要成分是氮气、氢气、一氧化碳、二氧化碳、水)。如图是一种工业上以半水煤气、食盐等为原料制取纯碱的流程。 资料:同温同压下,相同体积的气体含有相同的分子数。 (1)若原料中 V(H2):V(CO):V(N2)=19:14:11,则经 CO转化后的气体中 V(H2):V(N2)=_ (2)反应 2 中往往先通入 NH3,然后再通入 CO2,从溶解性的角度分析,其目的是_ (3)反应 3 得到的副产品是常见的铵态氮肥,确定该物质是铵盐的方法_ (4)反应 4 中加热碳酸氢钠晶体可得到纯碱,该反应的化学方程式_ 29. 在“钙之旅”专题复习课上,同学们对干燥剂中的钙进行了如下探究。
19、【提出问题】一包生石灰干燥剂使用一段时间后,该固体粉末中可能含有哪些物质? 【猜想与假设】氧化钙、氢氧化钙、碳酸钙中的一种或几种。 .定性探究固体的成分: 实验步骤 实验现象 实验结论 向烧杯中加入约 30ml水,用温度计测定温度 t1,再向水中加入一定量的该固体粉末,用温度计测定温度 t2 _ 该固体中含有氧化钙 取上述反应后的混合物,静置,向上层清液中滴加无色酚酞试液 无色酚酞变红 该固体中含有氢氧化钙 向上述混合物中滴加_ 固体消失, 有气泡产生 该固体中含有碳酸钙 【反思与评价】小明认为仅根据上述实验无法判断是否有氢氧化钙。理由是:_。 .定量探究固体的成分:为了进一步确定固体样品的成
20、分,实验小组称取 mg样品(己干燥)利用如图所示的装置(夹持仪器省略)进行实验。 【查阅资料】Ca(OH)2加热至 580、CaCO3加热至 825分别分解生成两种氧化物。 【实验步骤】 (1)实验前首先要_,再装入样品。 (2)连接好装置,先通入一段时间空气,测量装置 C、D 的质量。 (3)控温加热使装置 B 中反应完全,再通一段时间空气,再次测量装置 C、D的质量。 【实验分析】 (1)A的作用是_,步骤(3)中再通一段时间空气的目的是_。 (2)若装置 C、D 分别增重 9.0g和 11.0g,则原固体样品中含有_物质。(填化学式) 【得出结论】若将装置 B中反应后剩余的固体氧化物加入
21、足量水中溶解,蒸发所得固体(不含水且蒸发过程中固体不分解)增重 18.0g。通过计算分析原固体样品的质量 m为_g。 20222022 年江苏省常州市金坛区中考二模化学试题年江苏省常州市金坛区中考二模化学试题 一、选择题一、选择题(本题包括本题包括 20 小题,每小题小题,每小题 2 分,共分,共 40 分分) 1. 下列物质的使用过程主要发生化学变化的是 A. 活性炭除色 B. 分离液态空气 C. 金属铝氧化 D. 氢氧化钠潮解 【答案】C 【解析】 【分析】化学变化是指有新物质生成的变化。物理变化是指没有新物质生成的变化。化学变化和物理变化的本质区别为是否有新物质生成。 【详解】A、活性炭
22、除色过程中没有新物质生成,属于物理变化,故选项错误; B、分离液态空气过程中没有新物质生成,属于物理变化,故选项错误; C、金属铝氧化过程中有新物质氧化铝生成,属于化学变化,故选项正确; D、氢氧化钠潮解过程中没有新物质生成,属于物理变化,故选项错误。 故选:C。 2. 碳酸氢钠的俗名是 A. 烧碱 B. 纯碱 C. 小苏打 D. 熟石灰 【答案】C 【解析】 【详解】A、烧碱是氢氧化钠,故 A 不正确; B、纯碱是碳酸钠,故 B 不正确; C、小苏打是碳酸氢钠,故 C 正确; D、熟石灰是氢氧化钙,故 D 不正确。故选 C。 3. 下列属于空气质量报告中需要监测的污染物是 A. 二氧化碳 B
23、. 氮气 C. 二氧化硫 D. 水蒸气 【答案】C 【解析】 【详解】空气质量报告中需要监测的污染物是颗粒物、细颗粒物、二氧化氮、二氧化硫、一氧化碳和臭氧,故选:C。 4. 下列常用调味品中,与水充分混合后不能形成溶液的是 A. 砂糖 B. 食盐 C. 白醋 D. 芝麻油 【答案】D 【解析】 【详解】A、砂糖与水充分混合后可以形成溶液,故 A 不符合题意; B、食盐与水充分混合后可以形成溶液食盐水,故 B 不符合题意; C、白醋与水充分混合后可以形成溶液,故 C 不符合题意; D、芝麻油与水充分混合后,形成的是乳浊液,故 D 符合题意。 故选:D。 5. 下列有关粗盐提纯实验中的相关装置和操
24、作,正确的是 A. 溶解粗盐 B. 过滤食盐水 C. 蒸发食盐水 D. 冷却蒸发皿 【答案】A 【解析】 【详解】A、溶解操作应在烧杯中进行,用玻璃棒不断搅拌,图中所示操作正确,故 A 正确; B、过滤液体时,要注意“一贴、二低、三靠”的原则,图中漏斗下端没有紧靠在烧杯内壁上,图中所示操作错误,故 B 错误; C、蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅,图中所示操作错误,故 C 错误; D、刚加热完的蒸发皿温度较高,为防止烫伤手,不能用手直接拿热的蒸发皿,应用坩埚钳夹取,图中所示操作错误,故 D 错误。 故选:A。 6. 下列人体所缺元素与引起的健康问题关系正确的是 A.
25、 缺铁会引起贫血 B. 碘过量会引起龋齿 C. 缺锌会导致甲状腺疾病 D. 缺钙会引起坏血病 【答案】A 【解析】 【详解】A、 铁是血红蛋白的成分,缺铁会引起贫血,故 A 正确; B、 碘是甲状腺激素的重要成分,缺碘易患甲状腺肿大,缺氟会引起龋齿;故 B 错误; C、锌影响人体发育,缺锌会引起生长迟缓,发育不良,缺碘会导致甲状腺疾病,故 C 错误; D、 钙主要存在于骨骼和牙齿中, 缺钙易患佝偻病或发生骨质疏松, 缺维生素 C 会引起坏血病, 故 D 错误。 故选 A。 7. 下列对历史上几项重要研究成果介绍错误的是 A. 波义耳发现了质量守恒定律 B. 张青莲精确测定了铈的相对原子质量 C


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2022 江苏省 常州市 金坛 中考 化学 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-215658.html