 2022年宁夏中考化学模拟冲刺试卷(二)含答案解析
2022年宁夏中考化学模拟冲刺试卷(二)含答案解析
《2022年宁夏中考化学模拟冲刺试卷(二)含答案解析》由会员分享,可在线阅读,更多相关《2022年宁夏中考化学模拟冲刺试卷(二)含答案解析(16页珍藏版)》请在七七文库上搜索。
1、2022 年宁夏中考化学模拟冲刺试卷(二)年宁夏中考化学模拟冲刺试卷(二) 一、单选题(本大题共 11 小题,共 22.0 分) 1. “推动绿色发展,促进人与自然和谐共生”是第十四个五年规划和年远景目标之一。下列做法与此理念不相符的是 A. 使用一次性碗筷,树立健康意识 B. 积极植树造林,改善空气质量 C. 工业废水经处理达标后排放,防止水体污染 D. 使用新型可降解塑料,减少“白色污染” 2. 下列为一些常见食物的近似,胃酸过多的人空腹时最适宜吃的食物是 A. 苹果: B. 橘子: C. 葡萄: D. 玉米粥: 3. 如图所示为今年在三星堆遗址中发现的金面具残片,经测定该面具含金量约为。
2、下列有关说法正确的是 A. 金的元素符号为 B. 金容易被锈蚀 C. 金单质由金原子构成 D. 金的相对原子质量为 4. 下列物质的用途体现了物质的物理性质的是 A. 用高粱酿造高粱酒 B. 液氮用于医疗麻醉 C. 一定条件下,石墨转化为金刚石 D. 一氧化碳用于冶炼金属 5. 下列实验操作的图示中正确的是 A. 点燃酒精灯 B. 检查装置气密性 C. 稀释浓硫酸 D. 测定溶液的 6. 某同学设计了如图探究燃烧条件的实验装置。通过振荡塑料瓶可以看到白磷燃烧水火相容的场景,停止振荡则白磷熄灭。该实验说明了燃烧需要的条件是 A. 振荡 B. 氧气 C. 温度达到可燃物的着火点 D. 可燃物 7.
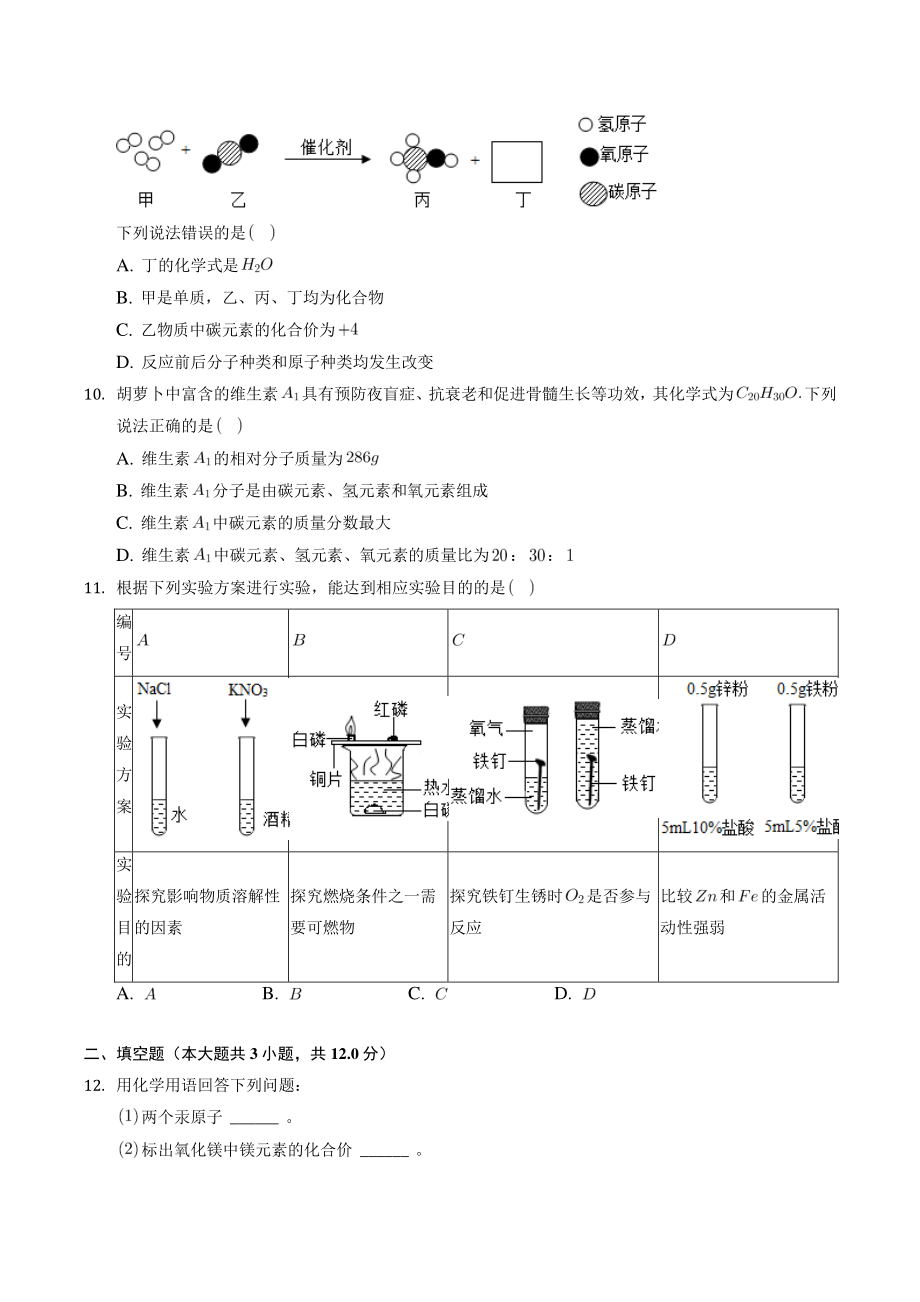
3、 下列有关解释错误的是 A. 服用含氢氧化铝的药物治疗胃酸过多是因为与盐酸发生了中和反应 B. 含盐酸的废水不能直接排入下水道是因为盐酸会与铁反应造成铸铁管腐蚀 C. 不能在铁质容器中配制波尔多液是由于铁能与硫酸铜发生化学反应 D. 幼儿患佝偻病和老年人骨质疏松都是因为碘元素的摄入过低 8. 如图是硼酸的溶解度曲线,下列说法正确的是 A. 点的硼酸溶液中溶质的质量分数为 B. 将点的硼酸溶液升温至时,仍是饱和溶液 C. 将 点的硼酸溶液降温至时,有晶体析出 D. 时,向水中加入硼酸后充分搅拌,可得溶液 9. 随着科学的发展,新能源的开发不断取得突破。清华大学研究人员成功研制出一种纳米纤维催化剂
4、,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图所示 图中的微粒恰好完全反应 。 下列说法错误的是 A. 丁的化学式是 B. 甲是单质,乙、丙、丁均为化合物 C. 乙物质中碳元素的化合价为 D. 反应前后分子种类和原子种类均发生改变 10. 胡萝卜中富含的维生素具有预防夜盲症、抗衰老和促进骨髓生长等功效,其化学式为下列说法正确的是 A. 维生素的相对分子质量为 B. 维生素分子是由碳元素、氢元素和氧元素组成 C. 维生素中碳元素的质量分数最大 D. 维生素中碳元素、氢元素、氧元素的质量比为: 11. 根据下列实验方案进行实验,能达到相应实验目的的是 编号 实验方案 实验目的 探究影响物质溶解
5、性的因素 探究燃烧条件之一需要可燃物 探究铁钉生锈时是否参与反应 比较和的金属活动性强弱 A. B. C. D. 二、填空题(本大题共 3 小题,共 12.0 分) 12. 用化学用语回答下列问题: 两个汞原子 _ 。 标出氧化镁中镁元素的化合价 _ 。 硫酸根离子 _ 。 空气中含量最多的气体 _ 。 13. 下列图示中,为实验装置或仪器,请结合所学知识回答有关问题: 实验室里用装置制备氧气的药品是 _; 实验室里制备二氧化碳的化学方程式是 _,请选择图中装置或仪器,组装一套实验室里制取二氧化碳的装置,该装置从左至右的顺序是 _ 填字母序号 。 14. 图 是关于氢氧化钠化学性质的思维导图,
6、请据图回答问题。 性质,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈 _ 色。 性质,将氢氧化钠溶液滴入稀盐酸中,图 表示该反应过程中溶液的变化曲线,点溶液中的溶质是 _ 填化学式 。 依据性质,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为 _ 。 性质,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐可能是 _ 。 三、简答题(本大题共 1 小题,共 7.0 分) 15. 扬州被称为运河之都、文化之都和美食之都,自古人文荟萃。 故人西辞黄鹤楼,烟花三月下扬州。唐 李白 孟浩然“下扬州”的交通工具是木船。现代游船常用玻璃钢制造船体,玻璃钢属于 _ 填“复合材料”或“金
7、属材料” 。 现代人远行可乘坐飞机。铝锂合金材料大量运用于国产大飞机的制造,下列不属于铝锂合金性质的是 _ 填字母 。 A.密度大 B.硬度大 C.抗腐蚀 天下三分明月夜,二分无赖是扬州。唐 徐凝 空气质量影响人们观赏明月。空气属于 _ 填“混合物”或“纯净物” 。 煤的气化和液化可实现能源清洁化,改善空气质量。水煤气中和在高温、高压和催化剂条件下合成甲醇,该反应的化学方程式是 _。 前日扬州去,酒熟美蟹蜊。宋 梅尧臣 蟹肉鲜美,富含蛋白质。蛋白质水溶液在加热时会生成沉淀,此沉淀 _ 填“能”或“不能”重新溶解于水中。 各种酒中都含有乙醇。在酿酒过程中,粮食中的 _ 填糖类名称 先转化为葡萄糖
8、,再经发酵生成乙醇。 四、探究题(本大题共 2 小题,共 18.0 分) 16. 学习小组同学在探究、的活动性顺序时,做了如图两个实验,并由此展开了一系列学习探究活动。 【学习交流】 实验中观察到,甲中铝丝表面附着一层 _ 色固体,乙中溶液颜色变为 _ 色。 你认为通过上述实验 _ 填“能”或“不能” 得出三种金属的活动性强弱。 【拓展探究】 上述实验后,同学们想进行废液的处理与回收,于是将甲、乙中的溶液倒入同一烧杯中,观察到混合溶液 即废液 澄清透明。 同学们认为应该先确定废液中是否含有未反应完的和, 为此,他们进行了实验并记录如下: 序号 实验操作 实验现象 实验结论 实验 取少量废液于试
9、管中,加入 _ 溶液 无明显现象 废液中没有 实验 取少量废液于试管中,加入溶液 产生白色沉淀 废液中含有未反应完的 【反思评价】 讨论后大家一致认为实验 所得结论不合理。你认为理由是 _ 用化学方程式表示 。 【拓展应用】 同学们尝试从废液中回收铜,将过量铝粉加入废液中,充分反应后过滤,滤液中存在的金属阳离子是 _ 写离子符号 。 17. 某兴趣小组的同学对碳酸氢钠的化学性质进行了探究。请完成下面的探究活动。 【提出问题】碳酸氢钠在生产、生活中的用途很广泛,体现出它的多种化学性质,其溶液能与酸碱指示剂、酸、碱、盐发生反应吗? 【实验】溶液能否使酸碱指示剂变色? 取少量碳酸氢钠溶液于试管中,
10、滴加几滴酚酞试液, 振荡, 溶液变成红色, 说明碳酸氢钠溶液显 _性。 【实验】溶液能否与稀硫酸反应?取少量碳酸氢钠溶液于试管中,滴加稀硫酸,现象是 _, 反应的化学方程式为 _。 【实验】溶液能否与澄清石灰水反应? 向澄清石灰水中加入少量碳酸氢钠溶液,产生白色沉淀,该沉淀为 _。 【实验】溶液能否与溶液反应? 向溶液中加入溶液,观察到有气泡冒出,并生成绿色沉淀物,说明溶液能与溶液发生反应。 【查阅资料】绿色沉淀物的成分为碱式碳酸铜 碱式碳酸铜受热分解为氧化铜、二氧化碳和水 白色的无水硫酸铜粉末遇水会变成蓝色 【拓展探究】兴趣小组的同学用如图所示装置,继续验证受热分解的产物。 装置中盛放的试剂
11、名称是 _。 将如图装置按一定顺序组装进行实验可以验证分解产物中有和水,正确的组合顺序是_ 填端口字母,且每套装置只能选用一次 。 充分加热后,装置中绿色物质完全变成黑色粉末。小刚设计了一套实验方案来证实该黑色粉末是氧化铜而不是碳粉。该方案的操作步骤及实验现象 _,反应化学方程式为 _。 五、计算题(本大题共 1 小题,共 6.0 分) 18. 如图是氢氧化钠和稀盐酸反应的变化图,此实验是将_溶液填“氢氧化钠”或“稀盐酸” 滴入另一种溶液中。此实验取氢氧化钠溶液的质量为克,所用的稀盐酸溶液的溶质的质量分数为,求该氢氧化钠溶液中溶质的质量分数为多少? 答案和解析答案和解析 1.【答案】 【解析】
12、解:、多用一次性碗筷,增加了森林的砍伐,不利于环境保护,符合题意; B、植树造林能净化空气,并减少空气中粉尘的产生,有利于环境保护,故不符合题意; C.工业废水经处理达标后再排放,不含有毒重金属离子、腐蚀性等,可防止水体污染,故不合题意; D.塑料制品易造成白色污染,为减少“白色污染”,应回收废弃塑料、使用新型可降解塑料,故不符合题意。 故选:。 解答本题就需要从降低化石能源的消耗、开发使用新能源,从而减少二氧化碳的排放量,从而减少对大气的污染,减缓生态恶化等方面分析解答。 环境的污染与保护是社会关注的焦点问题,与之相关的考题就成为中考的热点之一。解答本题关键是看是否减少了对空气中可吸收颗粒物
13、的产生。 2.【答案】 【解析】解:人的胃液中含有盐酸,对于胃酸过多的人应降低其酸性,可食用碱性食物以中和多余的酸。 A、苹果的为,小于 ,显酸性,故选项错误。 B、柑桔的为,小于 ,显酸性,故选项错误。 C、葡萄的为,小于 ,显酸性,故选项错误。 D、玉米粥的为,呈弱酸性、中性或弱碱性,故选项正确。 故选:。 当溶液的等于 时,呈中性;当溶液的小于 时,呈酸性;当溶液的大于 时,呈碱性对于胃酸过多的人,空腹时最宜进食的食物应该是显弱碱性的食物。 本题难度不大,掌握溶液的酸碱性和溶液大小之间的关系是顺利解题的关键。 3.【答案】 【解析】解:、书写元素符号注意“一大二小”,金的元素符号是,故选
14、项说法错误。 B、金的化学性质稳定,不易被锈蚀,故选项说法错误。 C、金属是由原子直接构成的,金单质是由金原子构成的,故选项说法正确。 D、相对原子质量单位是“ ”,不是“克”,金的相对原子质量为,故选项说法错误。 故选:。 A、书写元素符号时应注意:有一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个字母大写,第二个字母小写。 B、根据金的化学性质,进行分析判断。 C、根据金属是由原子直接构成的,进行分析判断。 D、根据相对原子质量单位是“ ”,不是“克”,进行分析判断。 本题难度不大,掌握金属的化学性质、金属是由原子直接构成的、相对原子质量单位是“ ”等是正确解答本题的关键。
15、4.【答案】 【解析】解:、用高粱酿造高粱酒,需要通过化学变化才表现出来,是利用了其化学性质,故选项错误。 B、液氮用于医疗麻醉,是利用了液氮汽化吸热的性质,不需要发生化学变化就能表现出来,是利用了其物理性质,故选项正确。 C、一定条件下,石墨转化为金刚石,石墨和金刚石和碳元素形成的不同单质,需要通过化学变化才表现出来,是利用了其化学性质,故选项错误。 D、一氧化碳用于冶炼金属,是利用了一氧化碳具有还原性,需要通过化学变化才表现出来,是利用了其化学性质,故选项错误。 故选:。 物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质,据此进行分析判断。
16、本题难度不大,区分物质的用途是利用了物理性质还是化学性质,关键就是看利用的性质是否需要通过化学变化体现出来。 5.【答案】 【解析】解:、使用酒精灯时要注意“两查、两禁、一不可”,禁止用酒精灯去引燃另一只酒精灯,图中所示操作错误。 B、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确。 C、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;图中所示操作错误。 D、用试纸测定溶液的时,正确的操作方法为在白瓷板或玻璃片上放一小片试纸,用玻璃棒蘸取待测液滴到试纸上,把试纸显


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2022 宁夏 中考 化学 模拟 冲刺 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-207999.html