 2022年安徽省中考化学预测试卷(2)含答案解析
2022年安徽省中考化学预测试卷(2)含答案解析
《2022年安徽省中考化学预测试卷(2)含答案解析》由会员分享,可在线阅读,更多相关《2022年安徽省中考化学预测试卷(2)含答案解析(17页珍藏版)》请在七七文库上搜索。
1、20222022 年安徽省中考化学预测试卷(年安徽省中考化学预测试卷(2 2) 一、选择题(本大题包括一、选择题(本大题包括 1212 小题,每小题小题,每小题 1 1 分,共分,共 1212 分。每小题的分。每小题的 4 4 个选项中只有个选项中只有 1 1 个符合题意)个符合题意) 1.中华民族的发明创造为人类文明进步作出了巨大贡献。下列古代发明及应用中,不涉及化学变化的是( ) A B C D 陶瓷烧制 火药使用 粮食酿酒 甲骨刻字 2. 空气和水是我们赖以生存的基础。下列做法有利于保护空气和水资源的是( ) A生活污水集中处理后排放 B加高烟囱来防止空气污染 C为出行方便多开私家车 D
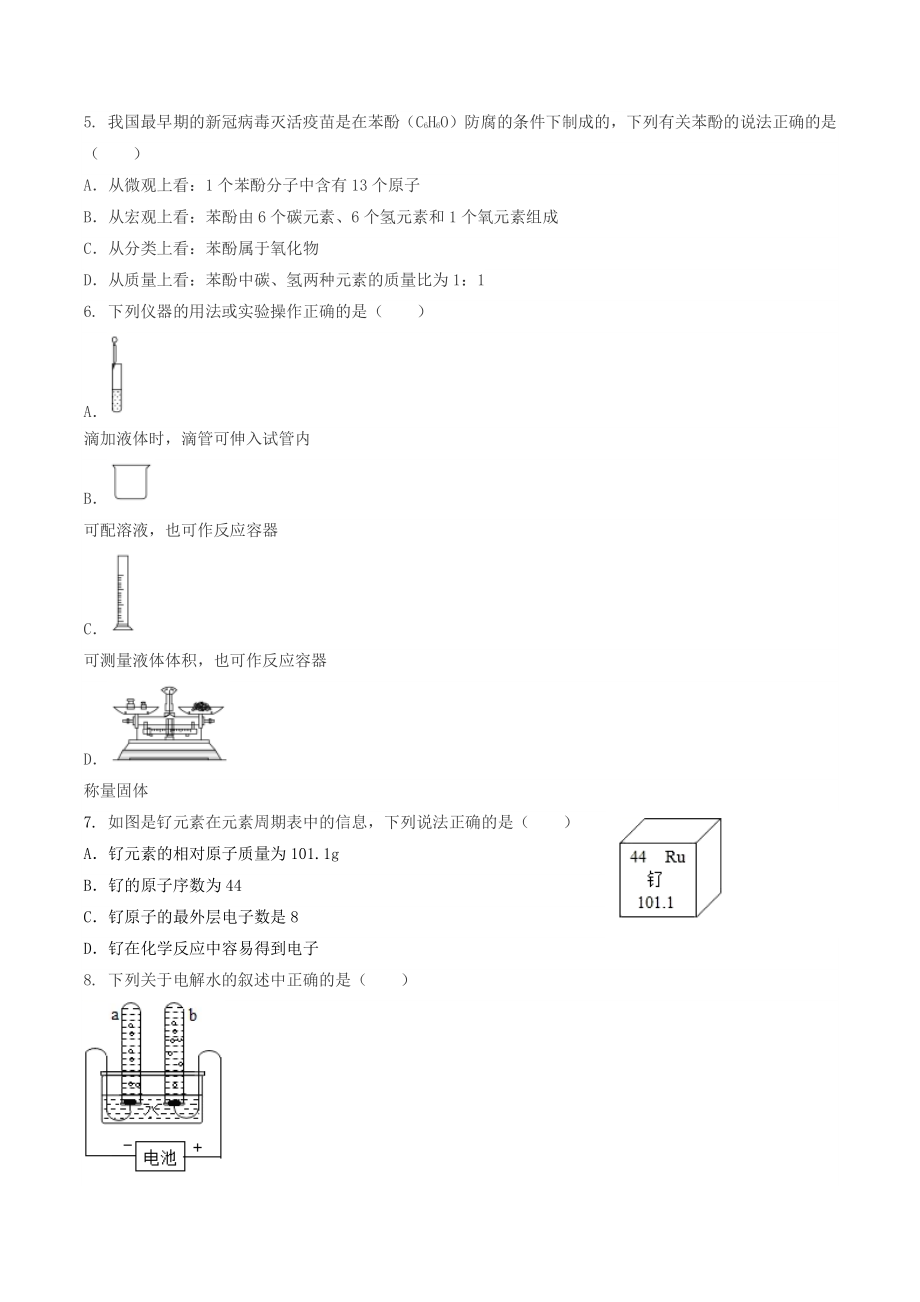
2、为了节水用工业废水灌溉农田 3. 如图危险标志中,与燃烧有关的是( ) A B C D 4. 为了给居民提供科学的健康膳食信息,做到合理营养,中国营养学会设计了“平衡膳食宝塔”(如图所示)。下列相关叙述错误的是( ) A“平衡膳食宝塔”提倡人们摄取全面而平衡的营养 B宝塔中 a 层食物最多,是为了保证人体能量的供应 C适量摄入 b 层食物可预防坏血病,但对治疗无作用 D生长发育关键期的青少年每天应多吃 c、d 层食物 5. 我国最早期的新冠病毒灭活疫苗是在苯酚(C6H6O)防腐的条件下制成的,下列有关苯酚的说法正确的是( ) A从微观上看:1 个苯酚分子中含有 13 个原子 B从宏观上看:苯酚
3、由 6 个碳元素、6 个氢元素和 1 个氧元素组成 C从分类上看:苯酚属于氧化物 D从质量上看:苯酚中碳、氢两种元素的质量比为 1:1 6. 下列仪器的用法或实验操作正确的是( ) A 滴加液体时,滴管可伸入试管内 B 可配溶液,也可作反应容器 C 可测量液体体积,也可作反应容器 D 称量固体 7. 如图是钌元素在元素周期表中的信息,下列说法正确的是( ) A钌元素的相对原子质量为 101.1g B钌的原子序数为 44 C钌原子的最外层电子数是 8 D钌在化学反应中容易得到电子 8. 下列关于电解水的叙述中正确的是( ) A电解水的实验证明水是由氢分子、氧分子组成的 B为增强水的导电性,常在水
4、中加入一定量的硫酸钠或氢氧化钠溶液 C若 a 试管气体为 5 mL,则 b 试管气体为 10 mL D与电源正极相连的玻璃管内得到的气体能在空气中燃烧 9. 某反应前后分子种类变化的微观示意图如图。下列说法正确的是( ) A丙的相对分子质量为 32 g B反应前后分子总数不变 C参加反应的甲、乙的质量比为 22:3 D该反应属于置换反应 10.下列依据证据得出的结论,错误的是( ) 选项 证据 结论 A 1 滴水约含 1.671021个水分子 水分子体积很小 B Cu 与 Hg(NO3)2溶液反应生成 Hg 和 Cu(NO3)2 Cu 的金属活动性比 Hg 的强 C 向某固体中加入稀盐酸,有气
5、体产生 该固体一定是 Na2CO3 D 白磷在热水中不燃烧,通入氧气后燃烧 氧气能支持白磷燃烧 AA BB CC DD 11.某实验小组用质量分数为 6%的氯化钠溶液(密度约为 1.04g/cm3)和水(密度约为 1g/cm3)配制 50g 质量分数为 3%的氯化钠溶液,下列说法错误的是( ) A实验的主要步骤有计算、量取、混匀、装瓶贴标签 B计算需要 6%的氯化钠溶液的质量是 25g(约 24.0mL),水的质量是 25g C实验中用到的玻璃仪器有量筒、试剂瓶、烧杯、玻璃棒、胶头滴管 D配制好的溶液装入试剂瓶时有液体溅出,溶质的质量分数变小 12. 如图,将胶头滴管中的物质 X 滴入装有物质
6、 Y 的试管中,两物质充分反应。下列说法错误的是( ) AX 为稀硫酸,若反应有气泡产生,则生成的气体一定是 H2 BX 为 AgNO3溶液,Y 为 Cu 片,根据现象可判断金属活动性:CuAg CX 为 BaCl2溶液,Y 为 Na2SO4溶液,反应产生白色沉淀 DX 为稀盐酸,Y 为 Al(OH)3,该反应可应用于治疗胃酸过多症 二、非选择题(本大题包括二、非选择题(本大题包括 5 5 小题,共小题,共 2828 分。)分。) 13. 化学源于生活。请应用所学化学知识回答下列问题: (1) “自热米饭” 的原理是: 加入水与发热包中的生石灰接触。 该反应的化学方程式为 。 (2)氢气和甲烷
7、都是清洁能源。 天然气是 (选填“可再生”或“不可再生”)能源。 充分燃烧 1g 氢气或甲烷释放的热量如图所示, 与甲烷相比,氢气为燃料的优点有无污染、 ;而日常生活中使用更多的是以甲烷为主要成分的天然气,原因是 (写出一点即可)。 (3)在抗击“新冠肺炎”疫情战斗中,人们采取了一系列行之有效的措施。 口罩是防疫必备品,其生产原料中用到的聚丙烯【(C3H6)n】属于 (选填“无机非金属材料”或“有机合成材料”),其中碳、氢元素的质量比为 。 测量体温是防控的重要环节。家庭常备体温计中的液态物质是 (填化学式)。 补充维生素提高人体免疫力。下列食品中富含维生素的是 (填字母)。 A.鸡肉 B.黄
8、瓜 C.面包 利用过氧乙酸溶液消毒。过氧乙酸溶液中通常含有过氧化氢、醋酸等物质,向其中加入下列物质,能产生气体的是 。 a.CuSO4 b.NaCl c.Na2CO3 d.MnO2 14.根据如图所示装置回答问题: (1)用高锰酸钾制取较纯净的氧气,选择的发生和收集装置组合是 ;请写出化学方程式 。 31.6 克的高锰酸钾完全反应后理论上试管内还剩 克固体。 (2)实验室选用 C 装置制取二氧化碳,可以控制反应的发生和停止,化学方程式是 ,而 C 装置用过氧化氢制取氧气却达不到控制反应的发生和停止效果,原因是 。 (3)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,密度比空气大,若用 G 装
9、置来收集 H2S,H2S 应从 进入(选“a”或“b”)。 15.从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示: (1)图中“操作”的名称是 。 (2)写出滤液中存在的金属阳离子 ,所得贵重金属中任意一种成分的化学式 。 (3)写出中发生的化学反应方程式 (任写一种);该反应的基本类型为 。 16.世界上每年因锈蚀而损失大量铁制品。某化学小组设计如下实验,探究铁生锈的条件及影响生锈速率的因素。 【进行实验】 实验 1:分别取铁钉按如图装置所示,放置一周,结果如下: 序号 1-1 1-2 1-3 实验 现象 无明显现象 无明显现象 铁钉表面有红色固体 实验 2:分别取
10、铁钉浸于等体积的不同试剂中,放置一周,结果如下: 序号 2-1 2-2 2-3 试剂种类 蒸馏水 3%的 NaCl 溶液 3%的稀盐酸 U 形管左侧液面 上升 1.2cm 上升 3.7cm 上升 5.3cm 【解释与结论】 (1)铁生锈属于 (填“物理”或“化学”)变化。 (2)铁锈中含有 Fe、O、H 元素,从元素守恒角度说明理由: 。 (3)实验 1 中,证明铁生锈需要与水接触的现象是 。 (4)实验 2-1 中,U 形管左侧液面上升的原因是 。 (5)实验 2 的目的是 。 【反思与评价】 (6)结合本实验,对于铁制品的保存,你的建议是 。 17.现有如图的氧气发生装置,取 50g 过氧
11、化氢溶液于分液漏斗 A 中,向 B 中加入 5g 二氧化锰,活塞 K 保持打开,不同时间电子天平的读数如表所示(不考虑 H2O 逸出): 反应时间/min 0 1 2 3 4 5 装置+过氧化氢溶液+二氧化锰/g 340.00 338.79 335.64 335.20 335.20 335.20 请根据要求回答下列问题: (1)生成氧气的质量为 g; (2)根据生成氧气的质量计算参加反应过氧化氢的质量。(根据化学方程式列式计算) 参考答案参考答案解析解析 一、选择题(本大题包括一、选择题(本大题包括 1212 小题,每小题小题,每小题 1 1 分,共分,共 1212 分。每小题的分。每小题的
12、4 4 个选项中只有个选项中只有 1 1 个符合题意)个符合题意) 1.中华民族的发明创造为人类文明进步作出了巨大贡献。下列古代发明及应用中,不涉及化学变化的是( ) A B C D 陶瓷烧制 火药使用 粮食酿酒 甲骨刻字 【解答】解:A、陶瓷烧制过程中有新物质生成,属于化学变化。 B、火药使用过程中有新物质生成,属于化学变化。 C、粮食酿酒过程中有新物质酒精生成,属于化学变化。 D、甲骨刻字过程中只是形状发生改变,没有新物质生成,属于物理变化。 故选:D。 2.空气和水是我们赖以生存的基础。下列做法有利于保护空气和水资源的是( ) A生活污水集中处理后排放 B加高烟囱来防止空气污染 C为出行
13、方便多开私家车 D为了节水用工业废水灌溉农田 【解答】解:A、生活污水集中处理后排放,有利于保护空气和水资源,故选项正确; B、加高烟囱不能防止空气污染,故选项错误; C、为出行方便多开私家车,增大空气污染,故选项错误; D、为了节水用工业废水灌溉农田,会造成水土污染,故选项错误; 故选:A。 3.如图危险标志中,与燃烧有关的是( ) A B C D 【解答】解:A、图中所示标志是腐蚀品标志,与燃烧无关,故选项错误。 B、图中标志是禁止有毒品标志,与燃烧无关,故选项错误。 C、图中所示标志是禁止烟火标志,与燃烧有关,故选项正确; D、图中标志为禁止接打手机标志,与燃烧无关,故选项错误; 故选:
14、C。 4.为了给居民提供科学的健康膳食信息,做到合理营养,中国营养学会设计了“平衡膳食宝塔”(如图所示)。下列相关叙述错误的是( ) A“平衡膳食宝塔”提倡人们摄取全面而平衡的营养 B宝塔中 a 层食物最多,是为了保证人体能量的供应 C适量摄入 b 层食物可预防坏血病,但对治疗无作用 D生长发育关键期的青少年每天应多吃 c、d 层食物 【解答】解:A、“平衡膳食宝塔”提倡人们摄取全面而平衡的营养,故 A 正确; B、 谷类富含糖类, 糖类是人体最主要的供能物质, 所以宝塔中 a 层食物最多, 是为了保证人体能量的供应,故 B 正确; C、果蔬类富含维生素 C,适量摄入 b 层食物可预防坏血病,
15、且对治疗也有效果,故 C 错误; D、 生长发育关键期的青少年每天需要摄入较多的蛋白质, 而乳类和肉类富含蛋白质, 因此青少年应多吃 c、d 层食物,故 D 正确。 故选:C。 5.我国最早期的新冠病毒灭活疫苗是在苯酚(C6H6O)防腐的条件下制成的,下列有关苯酚的说法正确的是( ) A从微观上看:1 个苯酚分子中含有 13 个原子 B从宏观上看:苯酚由 6 个碳元素、6 个氢元素和 1 个氧元素组成 C从分类上看:苯酚属于氧化物 D从质量上看:苯酚中碳、氢两种元素的质量比为 1:1 【解答】解:A、1 个苯酚分子是由 6 个碳原子、6 个氢原子、1 个氧原子构成的,则每个苯酚分子中含有13
16、个原子,故选项说法正确; B、苯酚是由碳、氢、氧三种元素组成的,故选项说法错误; C、氧化物含有两种元素,而苯酚是由碳、氢、氧三种元素组成的,苯酚不属于氧化物,故选项说法错误; D、苯酚中碳、氢元素的质量比(126):(16)=12:1,故选项说法错误; 故选:A。 6.下列仪器的用法或实验操作正确的是( ) B 滴加液体时,滴管可伸入试管内 B 可配溶液,也可作反应容器 C 可测量液体体积,也可作反应容器 D 称量固体 【解答】解:A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误,故选项错误。
17、B、烧杯可配溶液,也可作反应容器,说法正确,故选项正确。 C、量筒可测量液体体积,不能作反应容器,说法错误,故选项错误。 D、 托盘天平的使用要遵循 “左物右码” 的原则, 图中所示操作砝码与药品位置放反了, 图中所示操作错误,故选项错误。 故选:B。 7.如图是钌元素在元素周期表中的信息,下列说法正确的是( ) A钌元素的相对原子质量为 101.1g B钌的原子序数为 44 C钌原子的最外层电子数是 8 D钌在化学反应中容易得到电子 【解答】解: A、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为 101.1,相对原子质量单位是“1”,不是“g”,故选项说
18、法错误。 B、根据元素周期表中的一格可知,左上角的数字为 44,表示原子序数为 44;故选项说法正确。 C、钌是金属元素,最外层电子数小于 4,故选项说法不正确; D、钌是金属元素,最外层电子数小于 4,在化学反应中容易失去电子,该选项说法不正确。 故选:B。 8.下列关于电解水的叙述中正确的是( ) A电解水的实验证明水是由氢分子、氧分子组成的 B为增强水的导电性,常在水中加入一定量的硫酸钠或氢氧化钠溶液 C若 a 试管气体为 5 mL,则 b 试管气体为 10 mL D与电源正极相连的玻璃管内得到的气体能在空气中燃烧 【解答】解:A、电解水的实验证明水是由氢元素、氧元素组成的,故此选项错误


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2022 安徽省 中考 化学 预测 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 安徽2022
- 安徽2022语文
- 2017年安徽省中考化学试卷含详细答案
- 2022年安徽省中考物理导向模拟试卷含答案解析
- 安徽中考数学预测
- 2022年安徽省中考仿真化学试卷2含答案解析
- 2022年安徽省中考仿真语文试卷2含答案解析
- 2022年安徽中考
- 2022安徽
- 2022年安徽省中考数学试卷含答案解析
- 2022年安徽省中考试卷
- 2022年安徽省中考英语试卷
- 2022年安徽省中考语文试卷含答案解析
- 2022年宁夏中考预测化学试卷二含答案解析
- 2022年安徽省中考地理试卷含答案解析
- 2022年安徽省中考生物试卷含答案解析
- 2022年安徽省中考历史试卷含答案解析
- 2022年宁夏中考预测化学试卷一含答案解析
- 2022年安徽省中考化学试卷含答案解析
- 2022年安徽省中考英语试卷答案



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-206229.html