 2021年北京市普通高中学业水平等级性考试化学试卷(含答案)
2021年北京市普通高中学业水平等级性考试化学试卷(含答案)
《2021年北京市普通高中学业水平等级性考试化学试卷(含答案)》由会员分享,可在线阅读,更多相关《2021年北京市普通高中学业水平等级性考试化学试卷(含答案)(12页珍藏版)》请在七七文库上搜索。
1、2021 年普通高中学业水平等级性考试年普通高中学业水平等级性考试 北京卷北京卷 化学化学 可能用到的相对原子质量:可能用到的相对原子质量:H1 C12 N14 O16 第一部分第一部分 本部分共本部分共 14 题, 每题题, 每题 3分, 共分, 共 42 分。 在每题列出的四个选项中, 选出最符合题目要求的一项。分。 在每题列出的四个选项中, 选出最符合题目要求的一项。 1我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列关于黄芩素的说法不正确的是 A分子中有 3种官能团 B能与 Na2CO3溶液反应 C空气中可发生氧化反应 D能和 Br2发生取代反应和加成反应 2下列有关放射性
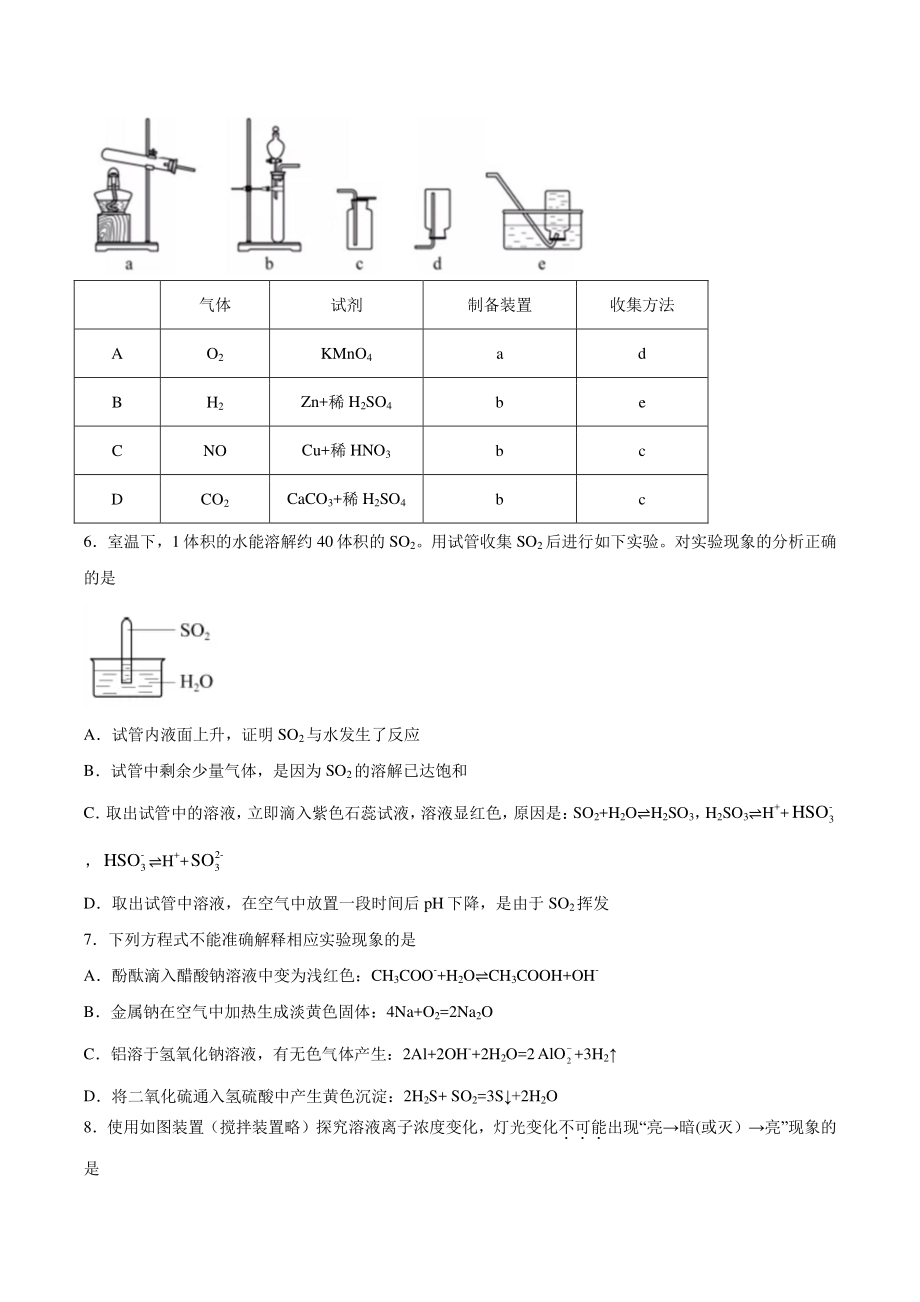
2、核素氚(31H)的表述不正确的是 A31H原子核外电子数为 1 B31H原子核内中子数为 3 C312H与 H2化学性质基本相同 D312H O具有放射性 3下列化学用语或图示表达不正确的是 AN2的结构式:NN BNa+的结构示意图: C溴乙烷的分子模型: DCO2的电子式: 4下列性质的比较,不能用元素周期律解释的是 A酸性:HClO4H2SO3H2SiO3 B碱性:KOHNaOHLiOH C热稳定性:H2OH2SPH3 D非金属性:FON 5实验室制备下列气体所选试剂、制备装置及收集方法均正确的是 气体 试剂 制备装置 收集方法 A O2 KMnO4 a d B H2 Zn+稀 H2SO
3、4 b e C NO Cu+稀 HNO3 b c D CO2 CaCO3+稀 H2SO4 b c 6室温下,1体积的水能溶解约 40 体积的 SO2。用试管收集 SO2后进行如下实验。对实验现象的分析正确的是 A试管内液面上升,证明 SO2与水发生了反应 B试管中剩余少量气体,是因为 SO2的溶解已达饱和 C 取出试管中的溶液, 立即滴入紫色石蕊试液, 溶液显红色, 原因是: SO2+H2OH2SO3, H2SO3H+-3HSO,-3HSOH+2-3SO D取出试管中溶液,在空气中放置一段时间后 pH下降,是由于 SO2挥发 7下列方程式不能准确解释相应实验现象的是 A酚酞滴入醋酸钠溶液中变为
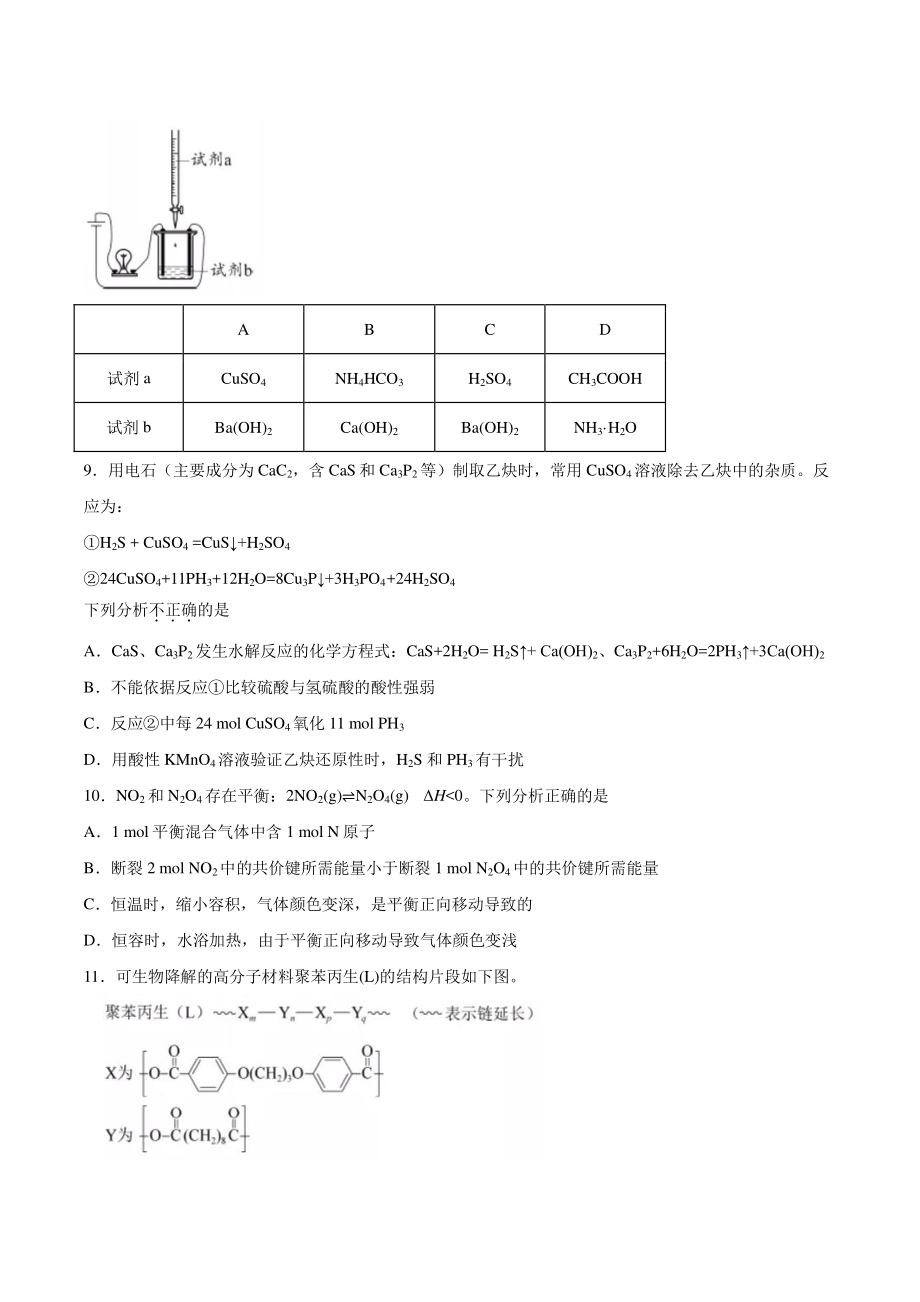
4、浅红色:CH3COO-+H2OCH3COOH+OH- B金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O C铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=22AlO+3H2 D将二氧化硫通入氢硫酸中产生黄色沉淀:2H2S+ SO2=3S+2H2O 8使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮暗(或灭)亮”现象的是 A B C D 试剂 a CuSO4 NH4HCO3 H2SO4 CH3COOH 试剂 b Ba(OH)2 Ca(OH)2 Ba(OH)2 NH3 H2O 9用电石(主要成分为 CaC2,含 CaS和 Ca3P2等)制取乙炔时,
5、常用 CuSO4溶液除去乙炔中的杂质。反应为: H2S + CuSO4 =CuS+H2SO4 24CuSO4+11PH3+12H2O=8Cu3P+3H3PO4+24H2SO4 下列分析不正确的是 ACaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O= H2S+ Ca(OH)2、Ca3P2+6H2O=2PH3+3Ca(OH)2 B不能依据反应比较硫酸与氢硫酸的酸性强弱 C反应中每 24 mol CuSO4氧化 11 mol PH3 D用酸性 KMnO4溶液验证乙炔还原性时,H2S 和 PH3有干扰 10NO2和 N2O4存在平衡:2NO2(g)N2O4(g) H0。下列分析正确的是 A
6、1 mol平衡混合气体中含 1 mol N 原子 B断裂 2 mol NO2中的共价键所需能量小于断裂 1 mol N2O4中的共价键所需能量 C恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的 D恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅 11可生物降解的高分子材料聚苯丙生(L)的结构片段如下图。 已知:R1COOH+R2COOH +H2O 下列有关 L的说法不正确的是 A制备 L的单体分子中都有两个羧基 B制备 L的反应是缩聚反应 CL中的官能团是酯基和醚键 Dm、n、p和 q的大小对 L的降解速率有影响 12下列实验中,均产生白色沉淀。 下列分析不正确的是 ANa2CO3与
7、NaHCO3溶液中所含微粒种类相同 BCaCl2能促进 Na2CO3、NaHCO3水解 CAl2(SO4)3能促进 Na2CO3、NaHCO3水解 D4 个实验中,溶液滴入后,试管中溶液 pH 均降低 13有科学研究提出:锂电池负极材料(Li)由于生成 LiH而不利于电池容量的保持。一定温度下,利用足量重水(D2O)与含 LiH的 Li负极材料反应,通过测定 n(D2)/n(HD)可以获知 n(Li)/n(LiH)。 已知:LiH+H2O=LiOH+H2 2Li(s)+H2(g)2LiH(s) H0 下列说法不正确的是 A可用质谱区分 D2和 HD BLi与 D2O的反应:2Li+2D2O=2
8、LiOD+D2 C若 n(Li)/n(LiH)越大,则 n(D2)/n(HD)越小 D80反应所得 n(D2)/n(HD)比 25反应所得 n(D2)/n(HD)大 14丙烷经催化脱氢可制丙烯:C3H8C3H6+H2。600,将一定浓度的 CO2与固定浓度的 C3H8通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO和 H2浓度随初始 CO2浓度的变化关系如图。 已知: C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) H -2220 kJ mol1 C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) H =-1926.1 kJ mol1 H2(g)+1/2
9、O2(g)=H2O(l) H =-286 kJ mol1 下列说法不正确的是 AC3H8(g)=C3H6(g)+H2(g) H =+124 kJ mol1 Bc(H2)和 c(C3H6)变化差异的原因:CO2+H2CO+H2O C其他条件不变,投料比 c(C3H8)/c(CO2)越大,C3H8转化率越大 D若体系只有 C3H6、CO、H2和 H2O 生成,则初始物质浓度 c0与流出物质浓度 c之间一定存在:3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6) 第二部分第二部分 本部分共本部分共 5 题,共题,共 58 分。分。 15 (9 分)环氧乙
10、烷(,简称 EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO 的原理示意图如下。 (1)阳极室产生 Cl2后发生的反应有:_、CH2=CH2+HClOHOCH2CH2Cl。 结合电极反应式说明生成溶液 a的原理_。 (2)一定条件下,反应物按一定流速通过该装置。 电解效率 和选择性 S 的定义: (B)= (B) ()生成 所用的电子通过电极的电子nn 100% S(B)= (B) ()生成 所用的乙烯转化的乙烯nn 100% 若 (EO)=100%,则溶液 b的溶质为_。 当乙烯完全消耗时,测得 (EO)70%,S(EO)97%。推测 (EO)70%的原因: I阳极有 H2O 放电

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2021 北京市 普通高中 学业 水平 等级 考试 化学 试卷 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-206141.html