 辽宁省阜新市海州2019届高三第一次月考化学试卷(含答案)
辽宁省阜新市海州2019届高三第一次月考化学试卷(含答案)
《辽宁省阜新市海州2019届高三第一次月考化学试卷(含答案)》由会员分享,可在线阅读,更多相关《辽宁省阜新市海州2019届高三第一次月考化学试卷(含答案)(11页珍藏版)》请在七七文库上搜索。
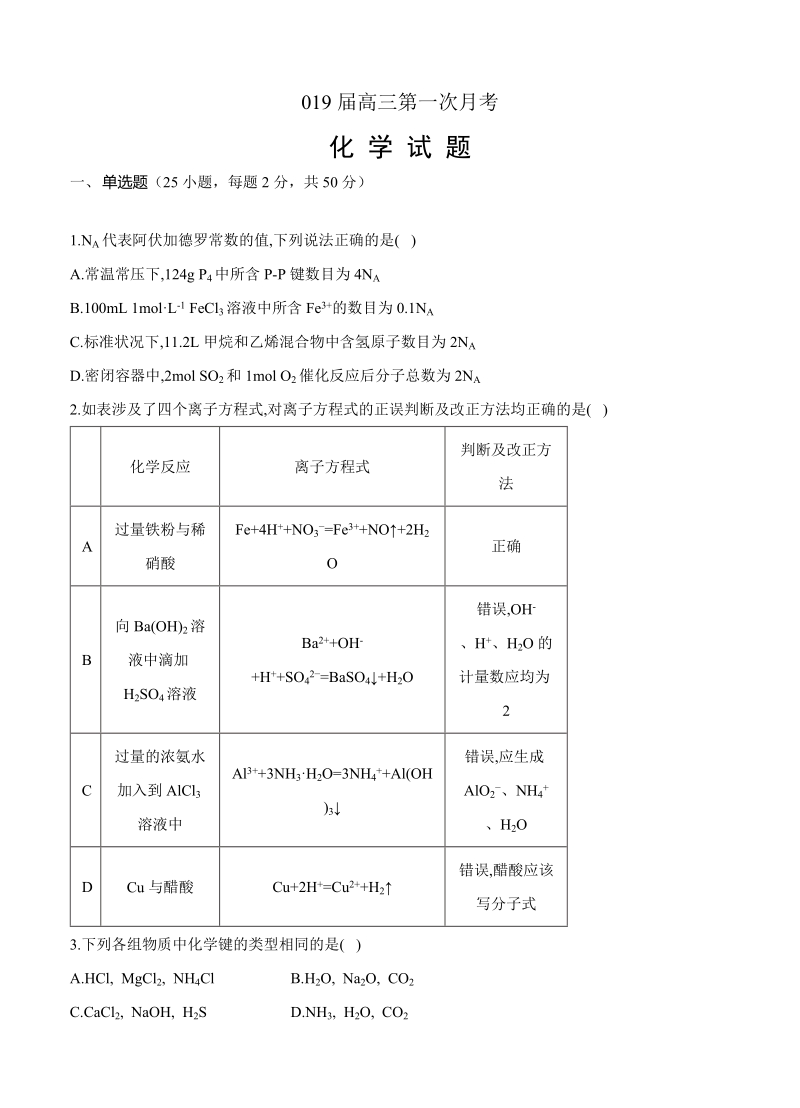
1、019 届高三第一次月考化 学 试 题一、 单选题(25 小题,每题 2 分,共 50 分)1.NA 代表阿伏加德罗常数的值,下列说法正确的是( )A.常温常压下,124g P 4 中所含 P-P 键数目为 4NAB.100mL 1molL-1 FeCl3 溶液中所含 Fe3+的数目为 0.1NAC.标准状况下,11.2L 甲烷和乙烯混合物中含氢原子数目为 2NAD.密闭容器中,2mol SO 2 和 1mol O2 催化反应后分子总数为 2NA2.如表涉及了四个离子方程式,对离子方程式的正误判断及改正方法均正确的是( )化学反应 离子方程式判断及改正方法A过量铁粉与稀硝酸Fe+4H+NO3=
2、Fe3+NO+2H2O正确B向 Ba(OH)2 溶液中滴加H2SO4 溶液Ba2+OH-+H+SO42=BaSO4+H2O错误,OH -、H +、H 2O 的计量数应均为2C过量的浓氨水加入到 AlCl3溶液中Al3+3NH3H2O=3NH4+Al(OH)3错误,应生成AlO2、NH 4+、H 2OD Cu 与醋酸 Cu+2H+=Cu2+H2错误,醋酸应该写分子式3.下列各组物质中化学键的类型相同的是( )A.HCl, MgCl2, NH4Cl B.H2O, Na2O, CO2C.CaCl2, NaOH, H2S D.NH3, H2O, CO24.已知反应2FeCl 3+2KI=2FeCl2+
3、2KCl+I2;KClO 3+6HCl=KCl+3Cl2+3H2O;2FeCl 2+Cl2=2FeCl3,下列物质的氧化能力强弱顺序正确的是( )A.FeCl3Cl2I2KClO3 B.KClO3Cl2FeCl3I2 C.Cl2KClO3FeCl3I2 D.KClO3Cl2I2FeCl35.下列变化过程,属于放热反应的是( )碳与水蒸气生成一氧化碳和氢气 酸碱中和反应 铝粉与氧化铁粉末反应 固体 NaOH 溶于水 H 2 在 Cl2 中燃烧 碳酸钙高温分解A. B. C. D.6.2.3 钠在干燥的空气中与氧气反应,可得 3.5 固体,据此可判断其产物( )ggA.只有 B.只有 C. 和 的
4、混合物 D.无法判断2aNO2a2NO2a7.对于 A2+3B2 2C+D 的反应来说 ,以下化学反应速率的表示中,反应速率最快的是( )A.v(B2)=0.8mol(Ls)-1 B.v(A2)=0.4 mol(Ls)-1C.v(C)=0.6 mol (Ls)-1 D.v(D)=0.1 mol(Ls)-18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )A.使甲基橙变红色的溶液: 、 、 、2MgK24SO3NB.使酚酞变红色的溶液: 、 、 、NaCu3HC.0.1 溶液: 、 、 、1molL3AO24ID.0.1 溶液: 、 、 、2l l24SO9.短周期元素 X、Y、Z、W
5、 、 Q 在元素周期表中的相对位置如图所示。下列说法不正确的是( )A.离子半径的大小顺序为:r(W 2-)r(Q-)r(Y2-)r(Z3+)B.元素 W 的最高价氧化物对应水化物的酸性比 Q 的强C.元素 X 的氢化物与 Q 的氢化物化合的产物中既含共价键又含离子键D.X、Z、W、 Q 四种元素的最高价氧化物对应水化物均能与强碱反应10.如下图所示是验证氯气性质的微型实验, 、 、 、 是浸有相关溶液的滤纸。向 晶体abde4KMnO上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知: 4216KMnOHCl。对实验现象的“解释或结论”正确的是( )2258KClMnClHO选项 实验现象
6、解释或结论A 处变蓝, 处变红棕色ab氧化性: 22ClBrIB 处先变红,后褪色c氯气与水生成了酸性物质C 处立即褪色d氯气与水生成了漂白性物质D 处变红色e还原性: 2FeCl11.下列说法或表示方法正确的是( )A.等质量的硫蒸气和硫固体分别完全燃烧 ,后者放出的热量多B.由 C(s,石墨) C(s,金刚石) H=+119kJmol -1 可知,金刚石比石墨稳定C.在稀溶液中:H +(aq)+OH-(aq) H2O(l) H=-57.3 kJmol-1,若将含 0.5mol H2SO4 的浓硫酸与含 1mol NaOH 的稀溶液混合,放出的热量大于 57.3kJD.在 25、101kPa
7、 时,2g H 2 完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g) 2H2O(l) H=285.8kJmol-112.在密闭容器中进行反应:2SO 2(g)+O2(g) 2SO3(g)(正反应放热 ),如图是某次实验的化学反应速率随时间变化的图像,推断在 t1 时刻突然变化的条件可能是 ( )A.催化剂失效 B.减小生成物的浓度C.降低体系温度 D.增大容器的体积13.为测定某镁铝合金样品中铝的含量,某同学进行了如下实验:取一定量合金,加入 100 mL 0.3 molL-1稀硫酸,合金完全溶解,产生的气体在标准状况下的体积为 560 mL
8、;再加入 0.2 molL-1 NaOH 溶液至沉淀质量恰好不再变化,用去 350 mL NaOH 溶液。则所取样品中铝的物质的量为( )A.0.005 mol B.0.01 mol C.0.02 mol D.0.03 mol14.下列反应所得溶液中一定只含一种溶质的是( )A.向稀硝酸中加入铁粉 B.向氯化铝溶液中加入过量的氨水C.向 溶液中通入 气体NaOH2CD.向 、 的混合液中加入过量的 溶液4MgS24 2BaOH15.已知气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )A.2O3(g)=3O2(g) H0C.N2(g)+3H2(g)=2NH3(


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 辽宁省 阜新市 海州 2019 届高三 第一次 月考 化学 试卷 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-19221.html