 2020-2021年高考化学真题分项版汇编 专题09 反应速率、化学平衡(学生版)
2020-2021年高考化学真题分项版汇编 专题09 反应速率、化学平衡(学生版)
《2020-2021年高考化学真题分项版汇编 专题09 反应速率、化学平衡(学生版)》由会员分享,可在线阅读,更多相关《2020-2021年高考化学真题分项版汇编 专题09 反应速率、化学平衡(学生版)(9页珍藏版)》请在七七文库上搜索。
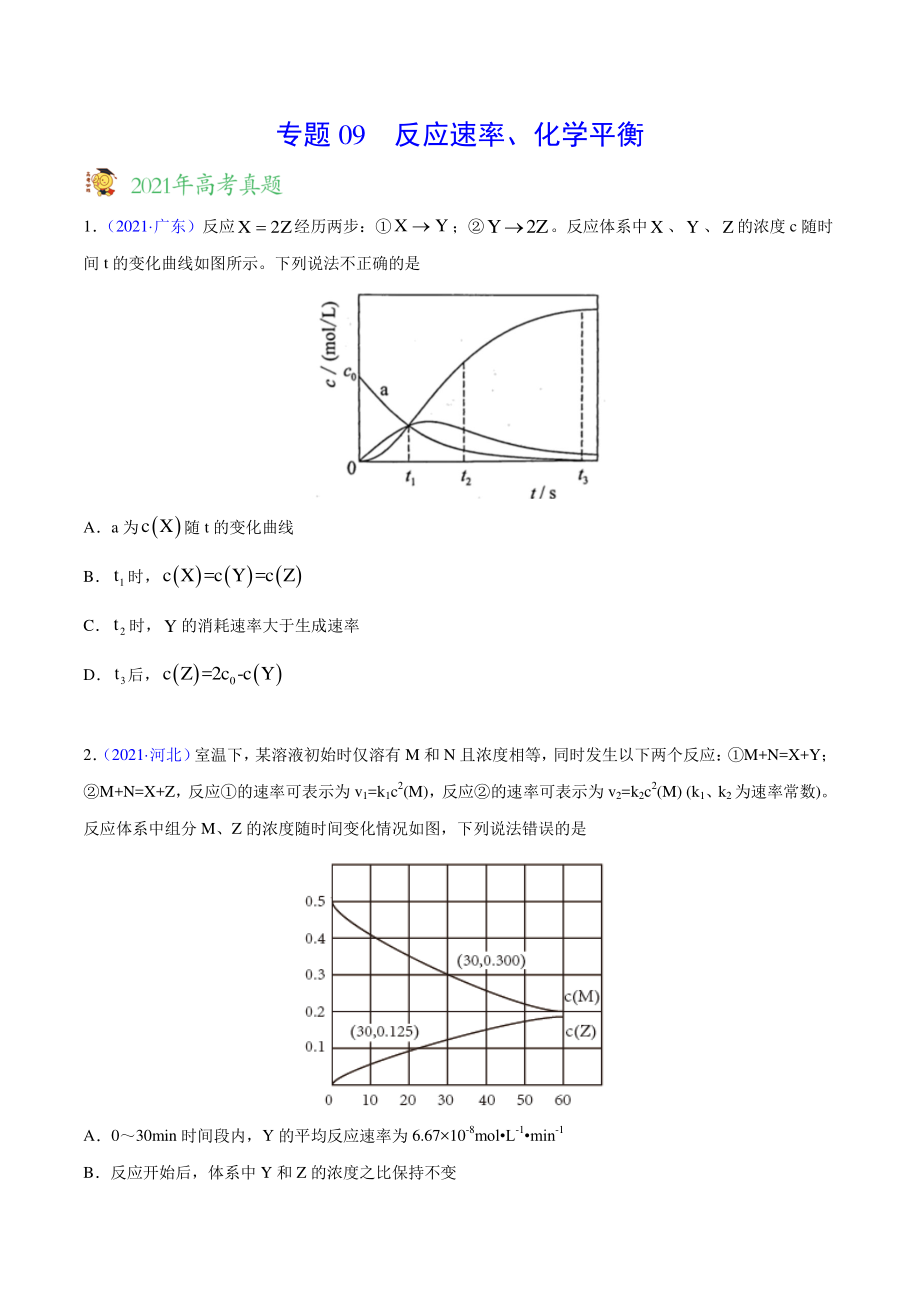
1、专题 09 反应速率、化学平衡 1 (2021 广东)反应X2Z经历两步:XY;Y2Z。反应体系中X、Y、Z的浓度 c 随时 间 t 的变化曲线如图所示。下列说法不正确的是 Aa 为 c X随 t 的变化曲线 B 1 t时, c X =c Y =c Z C 2 t时,Y的消耗速率大于生成速率 D 3 t后, 0 c Z =2c -c Y 2 (2021 河北) 室温下, 某溶液初始时仅溶有 M 和 N 且浓度相等, 同时发生以下两个反应: M+N=X+Y; M+N=X+Z, 反应的速率可表示为 v1=k1c2(M),反应的速率可表示为 v2=k2c2(M) (k1、k2为速率常数)。 反应体系
2、中组分 M、Z 的浓度随时间变化情况如图,下列说法错误的是 A030min 时间段内,Y 的平均反应速率为 6.67 10-8molL-1min-1 B反应开始后,体系中 Y 和 Z 的浓度之比保持不变 C如果反应能进行到底,反应结束时 62.5%的 M 转化为 Z D反应的活化能比反应的活化能大 3 (2021 浙江)相同温度和压强下,关于物质熵的大小比较,合理的是 A 42 1mol CH (g)1mol H (g) B 22 1mol H O(g)1mol H O(l) D 1mol C s1mol C s,金刚石 ,石墨 4 (2021 浙江)一定温度下:在 25 N O的四氯化碳溶液
3、(100mL)中发生分解反应: 2522 2N O4NO +O。 在不同时刻测量放出的 2 O体积,换算成 25 N O浓度如下表: t/s 0 600 1200 1710 2220 2820 x 1 25 c N O/ mol L 1.40 0.96 0.66 0.48 0.35 0.24 0.12 下列说法正确的是 A6001200s,生成2 NO的平均速率为 411 5.0 10 mol Ls B反应2220s时,放出的 2 O体积为11.8L(标准状况) C反应达到平衡时, 2正逆25 vN O=2vNO D推测上表中的 x 为 3930 5 (2021 浙江)取 50 mL 过氧化氢
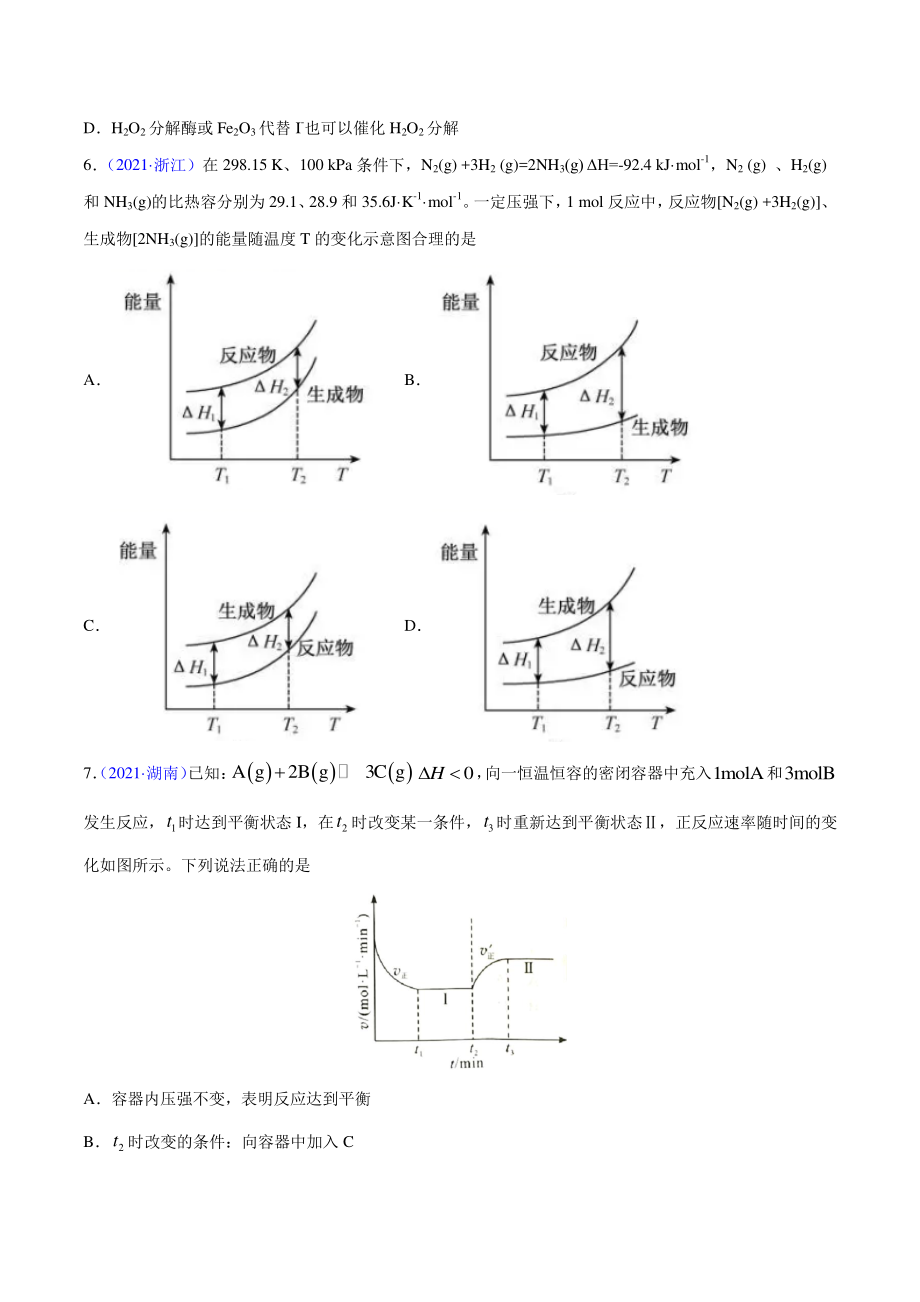
4、水溶液,在少量 I- 存在下分解:2H2O2=2H2O+O2。在一定温度下,测 得 O2的放出量,转换成 H2O2浓度(c)如下表: t/min 0 20 40 60 80 c/(mol L-1) 0.80 0.40 0.20 0.10 0.050 下列说法不正确的是 A反应 20min 时,测得 O2体积为 224mL(标准状况) B2040min,消耗 H2O2的平均速率为 0.010mol L-1 min-1 C第 30min 时的瞬时速率小于第 50min 时的瞬时速率 DH2O2分解酶或 Fe2O3代替 I-也可以催化 H2O2分解 6 (2021 浙江)在 298.15 K、100
5、 kPa 条件下,N2(g) +3H2 (g)=2NH3(g) H=-92.4 kJ mol-1,N2 (g) 、H2(g) 和 NH3(g)的比热容分别为 29.1、 28.9 和 35.6J K-1 mol-1。 一定压强下, 1 mol 反应中, 反应物N 2(g) +3H2(g)、 生成物2NH3(g)的能量随温度 T 的变化示意图合理的是 A B C D 7(2021 湖南) 已知: A g2B g3C g0H, 向一恒温恒容的密闭容器中充入1molA和3molB 发生反应, 1 t时达到平衡状态 I,在 2 t时改变某一条件, 3 t时重新达到平衡状态,正反应速率随时间的变 化如图
6、所示。下列说法正确的是 A容器内压强不变,表明反应达到平衡 B 2 t时改变的条件:向容器中加入 C C平衡时 A 的体积分数:(II) (I) D平衡常数 K:(II) (I)KK 1(2020 年浙江卷)5mL0.1mol L1KI溶液与1mL0.1mol L1FeCl3溶液发生反应:2Fe3+(aq) + 2I(aq) 2Fe2+(aq) + I2(aq),达到平衡。下列说法不正确 的是( ) A加入苯,振荡,平衡正向移动 B经苯 2 次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度 C加入FeSO4固体,平衡逆向移动 D该反应的平衡常数K= c2(Fe2+)
7、c2(Fe3+)c2 (I ) 2(2020 年浙江卷)一定条件下:2NO2(g) N2O4(g) H 0。在测定NO2的相对分子质量时,下列条件 中,测定结果误差最小的是( ) A温度0、压强50kPa B温度130、压强300kPa C温度25、压强100kPa D温度130、压强50kPa 3(2020 年江苏卷)CH4与 CO2重整生成 H2和 CO 的过程中主要发生下列反应 1 422 CH (g)CO (g)2H (g)2CO(g)247.1kJ molH 1 222 H (g)CO (g)H O(g)CO(g)41.2kJ molH 在恒压、反应物起始物质的量比 42 CH:CO

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020-2021年高考化学真题分项版汇编 专题09 反应速率、化学平衡学生版 2020 2021 年高 化学 真题分项版 汇编 专题 09 反应 速率 化学平衡 学生
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-188825.html