 2020-2021年高考化学真题分项版汇编 专题14 化学反应原理综合(学生版)
2020-2021年高考化学真题分项版汇编 专题14 化学反应原理综合(学生版)
《2020-2021年高考化学真题分项版汇编 专题14 化学反应原理综合(学生版)》由会员分享,可在线阅读,更多相关《2020-2021年高考化学真题分项版汇编 专题14 化学反应原理综合(学生版)(17页珍藏版)》请在七七文库上搜索。
1、专题 14 化学反应原理综合 1 (2021 山东卷)2甲氧基2甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯 烃的液相反应制得,体系中同时存在如图反应: 反应:+CH3OH 1 K H1 反应:+CH3OH 2 K H2 反应: 3 K H3 回答下列问题: (1)反应、以物质的量分数表示的平衡常数 Kx与温度 T 变化关系如图所示。据图判断,A和 B 中相对稳定的是_(用系统命名法命名); 1 2 H H 的数值范围是_(填标号)。 A1 (2)为研究上述反应体系的平衡关系,向某反应容器中加入 1.0molTAME,控制温度为 353K,测得 TAME 的平衡转化率
2、为 。已知反应的平衡常数 Kx3=9.0,则平衡体系中 B的物质的量为_mol,反应的平衡 常数 Kx1=_。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应的化学平衡将_(填“正向移 动”“逆向移动”或“不移动”)平衡时,A与 CH3OH物质的量浓度之比 c(A):c(CH3OH)=_。 (3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量 A、B和 CH3OH。控制温度 为 353K, A、 B 物质的量浓度 c随反应时间 t的变化如图所示。 代表 B 的变化曲线为_(填“X”或“Y”); t=100s 时,反应的正反应速率 v正_逆反应速率 v逆(填“”“”或“=
3、)。 2 (2021 浙江卷)含硫化合物是实验室和工业上的常用化学品。请回答: (1)实验室可用铜与浓硫酸反应制备少量 2 SO: 1 24422 Cu(s)2H SO (l)CuSO (s)SO (g)2H O(l)H= 11.9kJ mol。判断该反应的自发性并说 明理由_。 (2)已知 1 223 2SO (g)+O (g)2SO (g)H= 198kJ mol 。850K时,在一恒容密闭反应器中充入 一定量的 2 SO和 2 O,当反应达到平衡后测得 2 SO、 2 O和 3 SO的浓度分别为 31 6.0 10 mol L 、 31 8.0 10 mol L 和 12 4.4 10
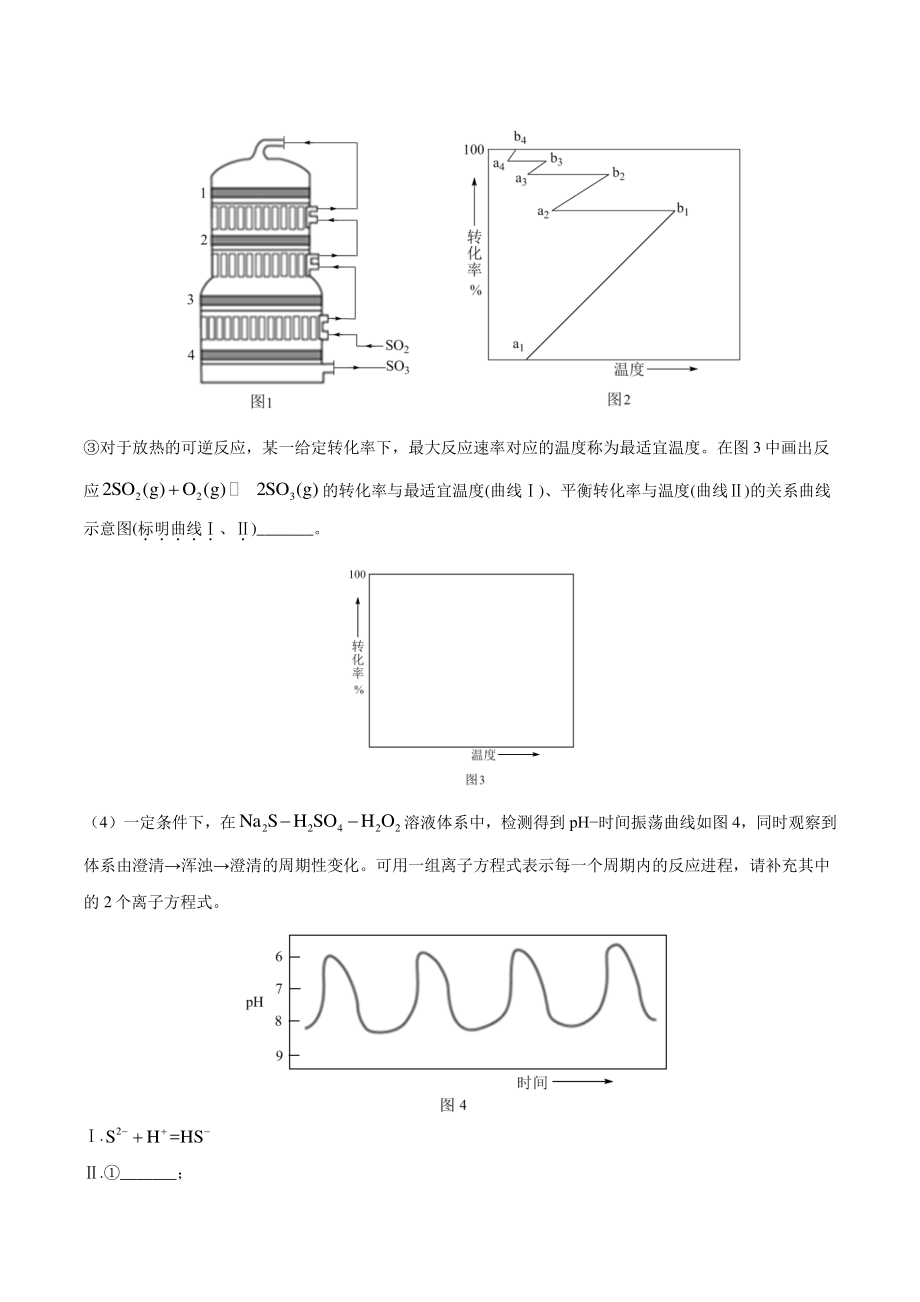
4、mol L 。 该温度下反应的平衡常数为_。 平衡时 2 SO的转化率为_。 (3)工业上主要采用接触法由含硫矿石制备硫酸。 下列说法正确的是_。 A须采用高温高压的反应条件使 2 SO氧化为 3 SO B进入接触室之前的气流无需净化处理 C通入过量的空气可以提高含硫矿石和 2 SO的转化率 D在吸收塔中宜采用水或稀硫酸吸收 3 SO以提高吸收速率 接触室结构如图 1 所示,其中 14表示催化剂层。图 2 所示进程中表示热交换过程的是_。 A 11 ab B 12 ba C 22 ab D 23 ba E. 33 ab F. 34 ba G. 44 ab 对于放热的可逆反应,某一给定转化率下,
5、最大反应速率对应的温度称为最适宜温度。在图 3 中画出反 应 223 2SO (g)O (g)2SO (g)的转化率与最适宜温度(曲线)、平衡转化率与温度(曲线)的关系曲线 示意图(标明曲线 、 )_。 (4)一定条件下,在 22422 Na SH SOH O溶液体系中,检测得到 pH时间振荡曲线如图 4,同时观察到 体系由澄清浑浊澄清的周期性变化。可用一组离子方程式表示每一个周期内的反应进程,请补充其中 的 2个离子方程式。 . 2 SH =HS ._; . 222 HSH OH =S2H O ; ._。 3 (2021 广东卷)我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和
6、。CH4与 CO2重整是 CO2利用 的研究热点之一。该重整反应体系主要涉及以下反应: a)CH4(g)+CO2(g)2CO(g)+2H2(g) H1 b)CO2(g)+H2(g)CO(g)+H2O(g) H2 c)CH4(g)C(s)+2H2(g) H3 d)2CO(g)CO2(g)+C(s) H4 e)CO(g)+H2(g)H2O(g)+C(s) H5 (1)根据盖斯定律,反应 a的H1=_(写出一个代数式即可)。 (2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_。 A增大 CO2与 CH4的浓度,反应 a、b、c的正反应速率都增加 B移去部分 C(s),反应 c、d、e 的平
7、衡均向右移动 C加入反应 a 的催化剂,可提高 CH4的平衡转化率 D降低反应温度,反应 ae的正、逆反应速率都减小 (3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分_步进行,其中,第_步的 正反应活化能最大。 (4)设 K r p为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体 的相对分压等于其分压(单位为 kPa)除以 p0(p0=100kPa) 。反应 a、c、e的 ln K r p随 1 T (温度的倒数)的 变化如图所示。 反应 a、c、e 中,属于吸热反应的有_(填字母)。 反应 c的相对压力平衡常数表达式为 K r p=_。 在图中
8、A点对应温度下、 原料组成为n(CO2):n(CH4)=1:1、 初始总压为100kPa的恒容密闭容器中进行反应, 体系达到平衡时 H2的分压为 40kPa。计算 CH4的平衡转化率,写出计算过程_。 (5)CO2用途广泛,写出基于其物理性质的一种用途:_。 4 (2021 全国乙卷)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机 合成中的碘化剂。回答下列问题: (1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig 误认为是 ICl,从而错过了一种新元素 的发现,该元素是_。 (2) 氯铂酸钡( 6 BaPtCl)固体加热时部分分解为 2 Ba
9、Cl、Pt和 2 Cl, 376.8时平衡常数 42 p K1.0 10 Pa , 在一硬质玻璃烧瓶中加入过量 6 BaPtCl, 抽真空后, 通过一支管通入碘蒸气(然后将支管封闭), 在 376.8, 碘蒸气初始压强为20.0kPa。376.8平衡时,测得烧瓶中压强为32.5kPa,则 ICl p=_kPa,反应 22 2ICl(g)Cl (g)I (g)的平衡常数 K=_(列出计算式即可)。 (3)McMorris测定和计算了在 136180范围内下列反应的平衡常数 p K 。 2p1 2NO(g)+2ICl(g)2NOCl(g)+I (g)K 2p2 2NOCl(g)2NO(g)+Cl
10、(g)K 得到 p1 1 lgK T 和 p2 1 lgK T 均为线性关系,如下图所示: 由图可知,NOCl分解为 NO 和 2 Cl反应的H_0(填“大于”或“小于”) 反应 22 2ICl(g)Cl (g)I (g)的 K=_(用 p1 K 、 p2 K 表示):该反应的H_0(填“大于”或“小 于”),写出推理过程_。 (4)Kistiakowsky曾研究了 NOCl光化学分解反应,在一定频率(v)光的照射下机理为: NOClhvNOCl 2 NOClNOCl2NOCl 其中hv表示一个光子能量,NOCl*表示 NOCl 的激发态。可知,分解 1mol的 NOCl 需要吸收_mol 光
11、子。 5 (2021 全国甲卷)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题: (1)二氧化碳加氢制甲醇的总反应可表示为: 2232 CO (g)3H (g)CH OH(g)H O(g) 该反应一般认为通过如下步骤来实现: -1 2221 CO (g)+H (g)=CO(g)+H O(g)H =+41kJ mol -1 232 CO(g)+2H (g)=CH OH(g)H =-90kJ mol 总反应的H=_ -1 kJ mol;若反应为慢反应,下列示意图中能体现上述反应能量变化的是 _(填标号),判断的理由是_。 A B C D (2)合成总反应在起始物 22 n H/n
12、 CO=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数 为 3 x(CH OH),在t=250下的 3 x CH OH p、在 5 p=5 10 Pa下的 3 x CH OH t如图所示。 用各物质的平衡分压表示总反应的平衡常数,表达式 p K =_; 图中对应等压过程的曲线是_,判断的理由是_; 当 3 x CH OH =0.10时, 2 CO的平衡转化率=_,反应条件可能为_或_。 6 (2021 河北卷)当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术, 降低空气中二氧化碳含量成为研究热点。 (1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃
13、烧。已知 25时,相关物质的燃烧热数 据如表: 物质 H2(g) C(石墨,s) C6H6(l) 燃烧热H(kJmol1) 285.8 393.5 3267.5 (1)则 25时 H2(g)和 C(石墨,s)生成 C6H6(l)的热化学方程式为_。 (2)雨水中含有来自大气的 CO2,溶于水中的 CO2进一步和水反应,发生电离: CO2(g)=CO2(aq) CO2(aq)+H2O(l)=H+(aq)+HCO 3 (aq) 25时,反应的平衡常数为 K2。 溶液中 CO2的浓度与其在空气中的分压成正比(分压=总压 物质的量分数),比例系数为 ymolL1kPa1,当 大气压强为 pkPa,大气
14、中 CO2(g)的物质的量分数为 x 时,溶液中 H+浓度为_molL1(写出表达式, 考虑水的电离,忽略 HCO3 的电离) (3)105时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s) M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为 46kPa。 保持温度不变,开始时在体系中先通入一定量的 CO2(g),再加入足量 MHCO3(s),欲使平衡时体系中水蒸气 的分压小于 5kPa,CO2(g)的初始压强应大于_kPa。 (4)我国科学家研究 LiCO2电池,取得了重大科研成果,回答下列问题: LiCO2电池中,Li为单质
15、锂片,则该电池中的 CO2在_(填“正”或“负”)极发生电化学反应。研究表明, 该电池反应产物为碳酸锂和单质碳,且 CO2电还原后与锂离子结合形成碳酸锂按以下 4 个步骤进行,写出 步骤的离子方程式。 .2CO2+2e=C2O 2 4 .C2O 2 4 =CO2+CO 2 2 ._ .CO 2 3 +2Li+=Li2CO3 研究表明,在电解质水溶液中,CO2气体可被电化学还原。 .CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_。 .在电解质水溶液中,三种不同催化剂(a、b、c)上 CO2电还原为 CO的反应进程中(H+被还原为 H2的反应 可同时发生),相对能量


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020-2021年高考化学真题分项版汇编 专题14 化学反应原理综合学生版 2020 2021 年高 化学 真题分项版 汇编 专题 14 化学反应 原理 综合 学生
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-188820.html