 2020-2021年高考化学真题分项版汇编 专题15 工艺流程题(学生版)
2020-2021年高考化学真题分项版汇编 专题15 工艺流程题(学生版)
《2020-2021年高考化学真题分项版汇编 专题15 工艺流程题(学生版)》由会员分享,可在线阅读,更多相关《2020-2021年高考化学真题分项版汇编 专题15 工艺流程题(学生版)(8页珍藏版)》请在七七文库上搜索。
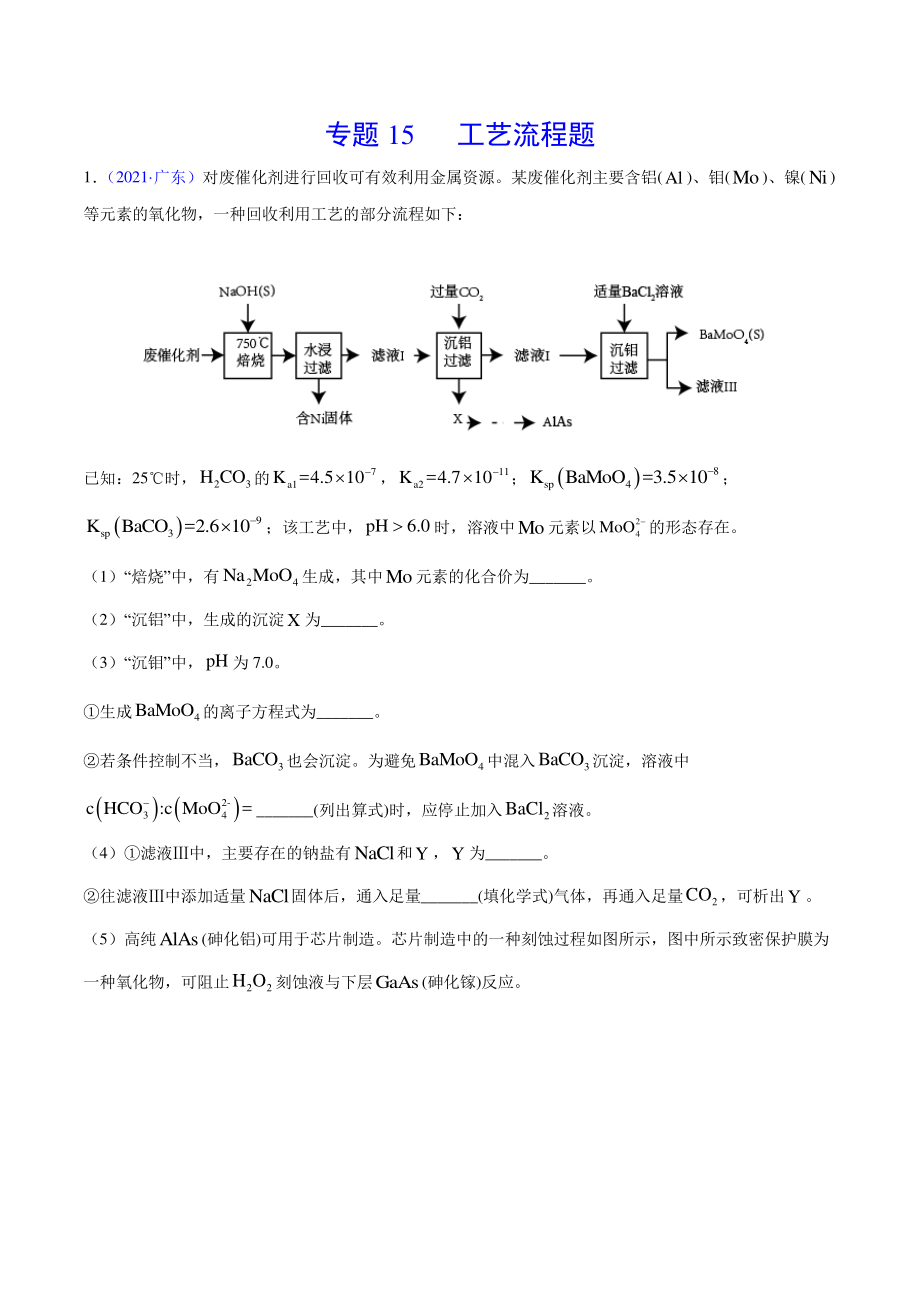
1、专题 15 工艺流程题 1 (2021 广东)对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni) 等元素的氧化物,一种回收利用工艺的部分流程如下: 已知:25时, 23 H CO的 7 a1 K =4.5 10, 11 a2 K =4.7 10; 8 sp4 KBaMoO=3.5 10; 9 sp3 KBaCO=2.6 10;该工艺中,pH6.0时,溶液中Mo元素以 2 4 MoO 的形态存在。 (1)“焙烧”中,有 24 Na MoO生成,其中Mo元素的化合价为_。 (2)“沉铝”中,生成的沉淀X为_。 (3)“沉钼”中,pH为 7.0。 生成 4 Ba
2、MoO的离子方程式为_。 若条件控制不当, 3 BaCO也会沉淀。为避免 4 BaMoO中混入 3 BaCO沉淀,溶液中 2- 34 c HCO:c MoO= _(列出算式)时,应停止加入 2 BaCl溶液。 (4)滤液中,主要存在的钠盐有NaCl和Y,Y为_。 往滤液中添加适量NaCl固体后,通入足量_(填化学式)气体,再通入足量 2 CO,可析出Y。 (5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为 一种氧化物,可阻止 22 H O刻蚀液与下层GaAs(砷化镓)反应。 该氧化物为_。 已知:Ga和Al同族,As和N同族。在 22 H O与上
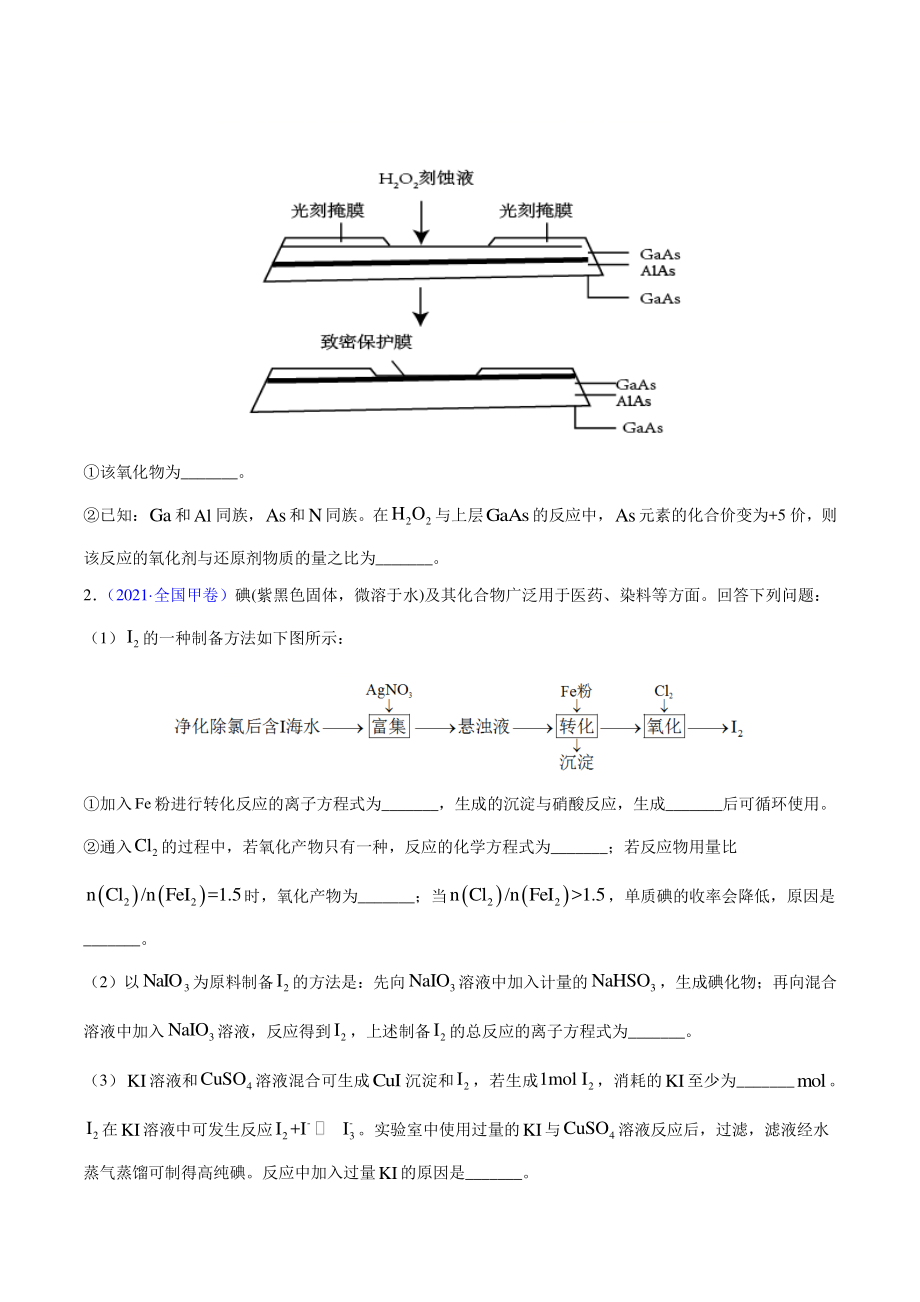
3、层GaAs的反应中,As元素的化合价变为+5 价,则 该反应的氧化剂与还原剂物质的量之比为_。 2 (2021 全国甲卷)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题: (1) 2 I的一种制备方法如下图所示: 加入Fe粉进行转化反应的离子方程式为_,生成的沉淀与硝酸反应,生成_后可循环使用。 通入 2 Cl的过程中,若氧化产物只有一种,反应的化学方程式为_;若反应物用量比 22 n Cl/n FeI=1.5时,氧化产物为_;当 22 n Cl/n FeI1.5,单质碘的收率会降低,原因是 _。 (2)以 3 NaIO为原料制备 2 I的方法是:先向 3 NaIO
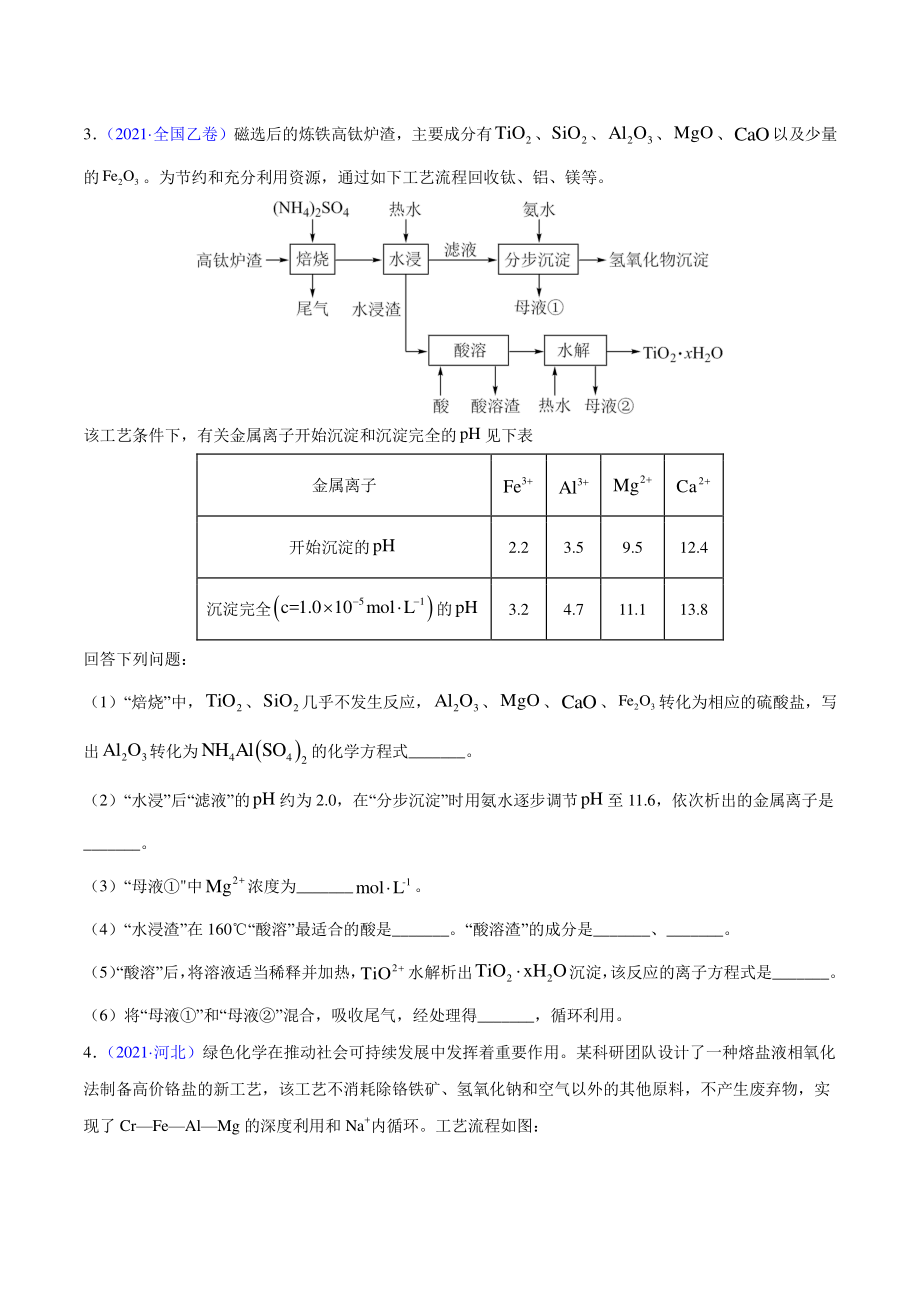
4、溶液中加入计量的 3 NaHSO,生成碘化物;再向混合 溶液中加入 3 NaIO溶液,反应得到 2 I,上述制备 2 I的总反应的离子方程式为_。 (3)KI溶液和 4 CuSO溶液混合可生成CuI沉淀和 2 I,若生成 2 1mol I,消耗的KI至少为_mol。 2 I在KI溶液中可发生反应 - 23 I +II。实验室中使用过量的KI与 4 CuSO溶液反应后,过滤,滤液经水 蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是_。 3 (2021 全国乙卷)磁选后的炼铁高钛炉渣,主要成分有 2 TiO、 2 SiO、 23 Al O、MgO、CaO以及少量 的 23 Fe O。为节约和充分
5、利用资源,通过如下工艺流程回收钛、铝、镁等。 该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表 金属离子 3 Fe 3 Al 2 Mg 2 Ca 开始沉淀的pH 2.2 3.5 9.5 12.4 沉淀完全 51 c=1.0 10 mol L 的pH 3.2 4.7 11.1 13.8 回答下列问题: (1)“焙烧”中, 2 TiO、 2 SiO几乎不发生反应, 23 Al O、MgO、CaO、 23 Fe O转化为相应的硫酸盐,写 出 23 Al O转化为 44 2 NH Al SO的化学方程式_。 (2)“水浸”后“滤液”的pH约为 2.0,在“分步沉淀”时用氨水逐步调节pH至 11
6、.6,依次析出的金属离子是 _。 (3)“母液中 2+ Mg浓度为_ -1 mol L。 (4)“水浸渣”在 160“酸溶”最适合的酸是_。“酸溶渣”的成分是_、_。 (5) “酸溶”后, 将溶液适当稀释并加热, 2 TiO 水解析出 22 TiOxH O沉淀, 该反应的离子方程式是_。 (6)将“母液”和“母液”混合,吸收尾气,经处理得_,循环利用。 4 (2021 河北)绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化 法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实 现了 CrFeAlMg 的深度利用和 Na+内循
7、环。工艺流程如图: 回答下列问题: (1)高温连续氧化工序中被氧化的元素是_(填元素符号)。 (2)工序的名称为_。 (3)滤渣的主要成分是_(填化学式)。 (4)工序中发生反应的离子方程式为_。 (5)物质 V 可代替高温连续氧化工序中的 NaOH,此时发生的主要反应的化学方程式为_,可 代替 NaOH 的化学试剂还有_(填化学式)。 (6)热解工序产生的混合气体最适宜返回工序_(填“”或“”或“”或“”)参与内循环。 (7)工序溶液中的铝元素恰好完全转化为沉淀的 pH 为_。(通常认为溶液中离子浓度小于 10-5molL-1为沉淀完全;A1(OH)3+OH-垐? 噲 ? Al(OH)4 :
8、K=100.63,Kw=10-14,KspA1(OH)3=10-33) 5 (2021 湖南) 23 3 Ce (C)O可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 4 CePO形 式存在,还含有 2 SiO、 23 Al O、 23 Fe O、 2 CaF等物质。以独居石为原料制备 23 32 )Ce (COnH O的工艺流 程如下: 回答下列问题: (1)铈的某种核素含有 58 个质子和 80 个中子,该核素的符号为_; (2)为提高“水浸”效率,可采取的措施有_(至少写两条); (3)滤渣的主要成分是_(填化学式); (4)加入絮凝剂的目的是_; (5)“沉铈”过程中
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020-2021年高考化学真题分项版汇编 专题15 工艺流程题学生版 2020 2021 年高 化学 真题分项版 汇编 专题 15 工艺流程 学生
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-188819.html