 2021年山东省威海市中考化学真题(含答案解析)
2021年山东省威海市中考化学真题(含答案解析)
《2021年山东省威海市中考化学真题(含答案解析)》由会员分享,可在线阅读,更多相关《2021年山东省威海市中考化学真题(含答案解析)(19页珍藏版)》请在七七文库上搜索。
1、2021 年山东省威海市中考化学试卷年山东省威海市中考化学试卷 一、选择(本题包括一、选择(本题包括 10 小题,每小题小题,每小题 2 分,共分,共 20 分。每小题只有一个选项符合题意)分。每小题只有一个选项符合题意) 1下列关于物质组成和构成的认识,不正确的是( ) A看似庞杂无序的化学物质均统一于种类有限的元素之中 B“元素论”和“原子分子论”是物质科学的基石,是科学和哲学的重要思想工具 C核外电子特别是外层电子,是决定原子间作用方式的重要原因 D跟卢瑟福原子模型比较,道尔顿原子模型不科学,对科学发展的贡献不大 2下列关于物质及变化的认识,正确的是( ) A电子、光子、量子属于化学物质
2、 B化学变化有可能创造出世界上原来不存在的物质 C任何变化都遵循质量守恒定律 D只有通过化学变化才能获得物质和能量 3如图为某反应的微观示意图,有关说法正确的是( ) A反应中丙、丁的化学计量数之比为 1:1 B反应前后各元素的化合价没有改变 C反应中物质乙发生还原反应 D反应前后甲、丁的质量比为 1:1 4下列物质的分类正确的是( ) A复合肥:硝酸钾、磷酸二氢铵、磷酸二氢钾 B合金:黄铜、青铜、氧化铜 C无机非金属材料:陶瓷、水泥、玻璃钢 D碱:火碱、纯碱、小苏打 5下列事实能用金属活动性解释的是( ) 铝制品比铁制品耐腐蚀 用硫酸铜溶液和铁制取铜 用稀盐酸除铁锈 金属铜不能与稀硫酸反应
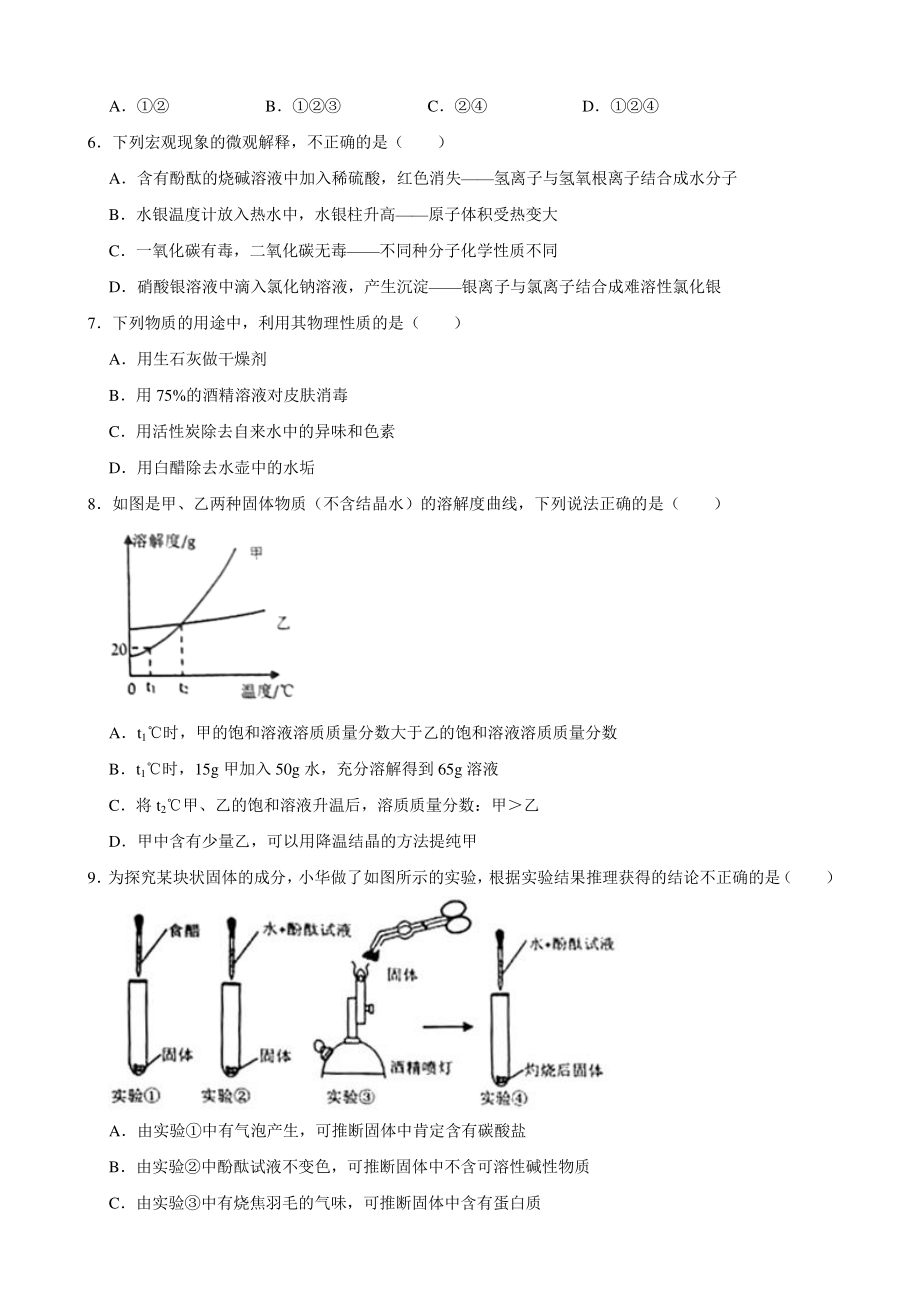
3、A B C D 6下列宏观现象的微观解释,不正确的是( ) A含有酚酞的烧碱溶液中加入稀硫酸,红色消失氢离子与氢氧根离子结合成水分子 B水银温度计放入热水中,水银柱升高原子体积受热变大 C一氧化碳有毒,二氧化碳无毒不同种分子化学性质不同 D硝酸银溶液中滴入氯化钠溶液,产生沉淀银离子与氯离子结合成难溶性氯化银 7下列物质的用途中,利用其物理性质的是( ) A用生石灰做干燥剂 B用 75%的酒精溶液对皮肤消毒 C用活性炭除去自来水中的异味和色素 D用白醋除去水壶中的水垢 8如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( ) At1时,甲的饱和溶液溶质质量分数大于乙的饱和溶液
4、溶质质量分数 Bt1时,15g 甲加入 50g 水,充分溶解得到 65g 溶液 C将 t2甲、乙的饱和溶液升温后,溶质质量分数:甲乙 D甲中含有少量乙,可以用降温结晶的方法提纯甲 9 为探究某块状固体的成分, 小华做了如图所示的实验, 根据实验结果推理获得的结论不正确的是 ( ) A由实验中有气泡产生,可推断固体中肯定含有碳酸盐 B由实验中酚酞试液不变色,可推断固体中不含可溶性碱性物质 C由实验中有烧焦羽毛的气味,可推断固体中含有蛋白质 D由实验中酚酞试液不变色、实验中试液变红色,可推断固体灼烧后生成新物质 10下列除杂方法(括号内为杂质) ,正确的是( ) 序号 混合物 除杂方法 A CO2
5、(HCl) 将混合气体依次通过浓 NaOH 溶液、浓硫酸 B Cu(CuO) 将混合物灼烧 C NaNO3固体(NH4NO3) 加适量的熟石灰研磨 D Na2SO4溶液(H2SO4) 加适量的碳酸钠溶液 AA BB CC DD 二、填空与简答(本大题共二、填空与简答(本大题共 4 小题,共小题,共 44 分)分) 11 (13 分) 焰火中的化学 五光十色的焰火让人叹为观止。 焰火中的白光主要是由金属镁燃烧产生。 如图是有关微粒的结构示意图, 请回答下列问题: (1)燃烧前 图中属于原子的有(填序号) ,属于阴离子的有(填序号) 。氧原子(填“能”或 “不能”) 直接构成物质。保持金属镁化学性
6、质的微粒是(填符号) 。 (2)燃烧中 在空气中点燃镁条,镁主要跟氧气反应,还能跟氮气反应生成少量氮化镁(氮元素显3 价) 。 镁跟氧气反应的微观实质是 。镁跟氮气反应的化学方程式为 ,所属基本反应类型 为 。 焰火中燃烧金属镁是为了把 能转化为 能。 (3)燃烧后 氧化镁能跟盐酸反应生成氯化镁。要把氯化镁中的镁元素重新分配到其它物质中,从化学变化中镁元素 化合价是否改变的角度,反应可分为两类,请举例说明(用化学方程式表示) 和 。 但无论化学反应多么复杂,从宏观看 不会消失,从微观看 不会消失。 12 (9 分) 碳中和,中国在行动 人类在向大自然获取物质和能源的过程中,对物质的循环产生影响
7、。有研究表明,大气中的碳元素只占 地球碳总量的 0.0000319%,通常这部分碳是通过自然界中的碳循环(包括大气、海洋、地表生物、火山 爆发等)实现平衡。由于人类过度开采使用地下碳(主要是化石燃料) ,导致工业革命以来碳排放量急剧 增加,正是这部分碳打破了大气中二氧化碳的平衡。 为减缓温室效应,我国政府向世界庄严承诺,中国将在 2060 年前实现碳中和。请回答以下问题: (1)“碳循环”与“碳中和”中的“碳”,含义是否相同? 为什么? 。 (2) 有人认为碳循环过程中碳元素的化合价始终保持不变, 你认为是否正确? , 你的证据是 (用 化学方程式表示) 。 (3)碳循环中的关键物质二氧化碳
8、天然气的主要成分是甲烧,若每个家庭每天平均消耗甲烷 0.32kg,按三亿个家庭计算,每天向大气中 排放 kg 二氧化碳(假设甲烷完全燃烧) 。 沼气的主要成分也是甲烧, 是利用植物秸秆等废物发酵而成。 为解决能源需求跟气候变暖之间的矛盾, 有学者建议: 用沼气替代天然气, 这样就不会额外增加二氧化碳的排放量。 请你解释其中的道理 。 某研究机构发明了转化大气中二氧化碳的技术。方法一:在一定条件下,二氧化碳和氢气反应生成甲 醇(CH3OH)和水,用甲醇生产人造纤维;方法二:将二氧化碳转化为甲醇后用作燃料。这两种转化方 法对大气中二氧化碳含量的影响是 (填“增加”“减少”“不影响”) : 方法一
9、; 方法二 。 13 (16 分) 探秘火星上的化学物质 2021 年 5 月 15 日,我国自主研制的天问一号搭载祝融号火星车,成功登陆火星。 研究表明,火星上有大气,但总量很小,密度只有地球空气的 1%左右,主要成分是二氧化碳,年平均气 温55,冬季最低至133,夏季最高至 27。火星地表没有发现水,但地表下发现有水冰的痕迹, 并有大量干冰。土壤及岩石中含有的无机盐跟地球相似,表层土壤主要为氧化铁。到目前为止,火星上 还没有发现生命迹象。 (1)下表是火星大气及土壤的部分成分。请你完善下表信息: 成分 二氧化碳 氮气 氩气 氧气 水蒸气 碳酸钙 构成微粒 (写符号) 体积分数 95.3%
10、2.7% 1.6% 0.15% 0.03% / ( 2 ) 已 知 干 冰 在 78.5 升 华 。 一 年 四 季 火 星 大 气 中 二 氧 化 碳 的 含 量 波 动 较 大 , 原 因 是 。 (3)移居火星是人类的梦想,根据题中信息回答:跟地球相比,火星上没有或含量不足以支持人类生命 活动的基本物质有哪些? 。 (4)要在太空中制取氧气、水和铁,有关物质的信息如下: 资料 1.用铁酸镍(NiFe2O4)做催化剂,用舱外太阳能电池发电,通电分解二氧化碳可生成氧气和碳。 资料 2.氮气的沸点196;氢气的沸点253;肼(分子式为 N2H4,读音:jing)的沸点 114;肼是 一种无色、
11、易挥发、有刺激性气味的油状液体,有腐蚀性,能腐蚀玻璃和橡胶,有剧毒。肼是航空器上 常用的燃料。 请根据提供的信息,探究制取氧气、水和铁的方法。 在密闭的太空舱中,用资料 1 中的方法制备氧气的优点是 ,该反应的化学方程 式为 。 肼在氧气中燃烧是否有可能获得水?请说明理由 。 已知肼在金属铂(Pt)的催化作用下,常温即可分解产生氢气和氮气。反应的化学方程式 为 。写出从氢气、氮气混合气体中分离出氢气的依据 。 分离出的氢气在氧气中燃烧可制得水。 根据资料 2 中肼的性质, 在使用肼制取氢气时, 为保障安全, 需要注意的问题有 。 以资料 1 中二氧化碳分解产生的碳、 火星大气中的二氧化碳和火星
12、土壤中的氧化铁为原料制备金属铁, 反应的化学方程式为 。 14 (6 分)证据推理 (1)在探究碱的性质时,用到了氢氧化钾,小铭在整理实验台时发现,盛有氢氧化钾固体的试剂瓶没有 盖 上 瓶 盖 。 他 认 为 瓶 中 氢 氧 化 钾 已 有 部 分 变 质 , 他 推 理 的 依 据 是 ( 用 化 学 方 程 式 表 示) 。要证明氢氧化钾部分变质,请写出实验步骤、可能的现象及相关推 理 。 (2)小铭在切圆葱时眼睛被刺激而流泪。小铭想:为什么圆葱会释放出催泪的物质?这种“催人泪下” 的物质有什么性质?小铭查阅资料得知:圆葱被切开时因破坏了细胞组织,生成了多种挥发性的能刺 激眼睛的物质(其中
13、含有少量 SO3) ,这些挥发性物质是“催人泪下”的元凶。SO3跟 CO2的化学性质 相似。 请你运用类比推理,写出三氧化硫跟水反应的化学方程式 。 若要避免切圆葱时眼睛流泪,请你给出两条建议。 , 。 三、计算(本大题共三、计算(本大题共 1 小题,共小题,共 6 分)分) 15 (6 分)为测定某盐酸的溶质质量分数,取 200 g 样品于烧杯中,将 50 g 碳酸钠溶液分为 5 等份,分 5 次加入盛有样品的烧杯中。测出每次反应后溶液的总质量,实验数据如下表: 第一次 第二次 第三次 第四次 第五次 加入 Na2CO3溶液的质量 10 g 10 g 10 g 10 g 10 g 反应后溶液
14、的质量 208.9 g 217.8 g 226.7 g 235.6 g 245.6 g 请根据实验数据计算盐酸的溶质质量分数。 参考答案及解析参考答案及解析 一、选择(本题包括一、选择(本题包括 10 小题,每小题小题,每小题 2 分,共分,共 20 分。每小题只有一个选项符合题意)分。每小题只有一个选项符合题意) 1下列关于物质组成和构成的认识,不正确的是( ) A看似庞杂无序的化学物质均统一于种类有限的元素之中 B“元素论”和“原子分子论”是物质科学的基石,是科学和哲学的重要思想工具 C核外电子特别是外层电子,是决定原子间作用方式的重要原因 D跟卢瑟福原子模型比较,道尔顿原子模型不科学,对
15、科学发展的贡献不大 【分析】A根据物质由元素组成进行分析; B根据“元素论”和“原子分子论”与科学的关系进行分析; C根据最外层电子数决定原子的化学性质进行分析; D根据道尔顿的原子模型对科学发展的重要性进行分析。 【解答】解:A所有物质均由元素组成,因此看似庞杂无序的化学物质均统一于种类有限的元素之中, 故说法正确; B“元素论”和“原子分子论”是物质科学的基石,是科学和哲学的重要思想工具,故说法正确; C原子核外的最外层电子数决定原子的化学性质,决定原子间作用的方式,故说法正确; D道尔顿的原子模型对科学发展有着重大贡献,故说法错误。 故选:D。 【点评】此题考查原子结构及原子结构的发现史
16、,难度不大,读懂题目联系所学便能解题。 2下列关于物质及变化的认识,正确的是( ) A电子、光子、量子属于化学物质 B化学变化有可能创造出世界上原来不存在的物质 C任何变化都遵循质量守恒定律 D只有通过化学变化才能获得物质和能量 【分析】A根据电子、光子、量子属于微观粒子分析; B根据化学具有创造性分析; C根据质量守恒定律的适用于化学变化分析; D根据有些物理变化也伴随着能量的变化分析。 【解答】A电子、光子、量子属于微观粒子,不属于化学物质,物质是宏观概念;故 A 错误; B利用化学知识,既可以提炼出自然界原来存在的物质,例如,从石油中提炼汽油、煤油、柴油等, 还可以制造出自然界原来并不存
17、在的物质,例如,用石油作原料制造塑料、合成纤维、合成橡胶、洗涤 剂等;故 B 正确; C质量守恒定律的适用于化学变化,任何化学变化都遵循质量守恒定律;故 C 错误; D有些物理变化也伴随着能量的变化,如物质的三态变化;故 D 错误。 故选:B。 【点评】本题主要对宏观物质、微观粒子及物质变化的认识,难度不大。 3如图为某反应的微观示意图,有关说法正确的是( ) A反应中丙、丁的化学计量数之比为 1:1 B反应前后各元素的化合价没有改变 C反应中物质乙发生还原反应 D反应前后甲、丁的质量比为 1:1 【分析】分析微观过程图可知,反应前由 1 个 C 原子和 1 个 O 原子构成的一个 CO 分子
18、与由 1 个 N 原子 和 1 个 O 原子构成的 NO 分子发生反应,生成了由 2 个 N 原子构成的 N2分子和由 2 个 O 原子与 1 个 C 原子构成的 CO2分子,写出反应的化学方程式据其意义分析判断有关的说法。 【解答】解:由反应的微观示意图可知,该反应的化学方程式可表示为:2CO+2NON2+2CO2。 A由方程式的意义可知,反应中丙、丁(即二氧化碳和氮气)的化学计量数之比为 2:1,选项说法错 误; B该反应有单质氮气生成,氮元素的化合价一丁发生了变化,选项说法错误; C由物质的变化可知,反应中物质乙是一氧化氮失去了氧,发生还原反应,选项说法正确; D由方程式的意义可知,反应
19、前后甲、丁一氧化碳和氮气的质量比(28 2) :282:1,选项说法错误。 故选:C。 【点评】本题考查了化学反应的微观模拟示意图,解决这种题的关键就是辨别分子是由何种原子构成, 每种原子有几个,这样就可以得出分子的化学式,再利用化学方程式对相关知识进行分析判断即可。 4下列物质的分类正确的是( ) A复合肥:硝酸钾、磷酸二氢铵、磷酸二氢钾 B合金:黄铜、青铜、氧化铜 C无机非金属材料:陶瓷、水泥、玻璃钢 D碱:火碱、纯碱、小苏打 【分析】A根据复合肥的判断方法考虑; B根据合金的特点考虑; C根据材料的分类考虑; D根据物质的分类考虑。 【解答】解:A硝酸钾、磷酸二氢铵、磷酸二氢钾都属于复合
20、肥,故 A 正确; B氧化铜属于纯净物,不属于合金,故 B 错; C玻璃钢属于复合材料,故 C 错; D纯碱、小苏打都属于盐,不属于碱,故 D 错。 故选:A。 【点评】解答本题关键是熟悉物质的分类,知道材料的分类,复合肥的判断方法。 5下列事实能用金属活动性解释的是( ) 铝制品比铁制品耐腐蚀 用硫酸铜溶液和铁制取铜 用稀盐酸除铁锈 金属铜不能与稀硫酸反应 A B C D 【分析】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,且金属的活动性越强,反应越剧 烈;位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此结合事实进行分析判断。 【解答】解:铝制品比铁制品耐腐蚀,原因是铝
21、易与氧气反应生成了一层致密的氧化铝薄膜,阻止了 反应的进一步进行,不能说明铁的活动性比铝强,不能用金属活动性解释; 用硫酸铜溶液和铁制取铜,是由于铁比铜活泼,铁能将铜置换出来,能用金属活动性解释; 用稀盐酸除铁锈,是酸与金属氧化物反应,不能用金属活动性解释; 金属铜不能与稀硫酸反应,是由于铜位于氢的后面,能用金属活动性解释; 由以上分析可知,C 正确。 故选:C。 【点评】本题难度不大,考查了金属活动性顺序的应用,掌握金属活动性顺序并能灵活运用是正确解答 此类题的关键所在。 6下列宏观现象的微观解释,不正确的是( ) A含有酚酞的烧碱溶液中加入稀硫酸,红色消失氢离子与氢氧根离子结合成水分子 B
22、水银温度计放入热水中,水银柱升高原子体积受热变大 C一氧化碳有毒,二氧化碳无毒不同种分子化学性质不同 D硝酸银溶液中滴入氯化钠溶液,产生沉淀银离子与氯离子结合成难溶性氯化银 【分析】A根据酸碱中和原理考虑; B根据水银温度计放入热水中,水银柱升高的原因考虑; C根据分子的性质考虑; D根据硝酸银与氯化钠反应的实质考虑。 【解答】解:A含有酚酞的烧碱溶液中加入稀硫酸,红色消失,是因为氢离子与氢氧根离子结合成水 分子,故 A 说法正确; B水银温度计放入热水中,水银柱升高的原因是:汞原子之间的间隔变大,故 B 说法错误; C同种分子化学性质相同,不同分子化学性质不同,故 C 说法正确; D硝酸银与
23、氯化钠反应生成氯化银白色沉淀和硝酸钠,产生的沉淀是银离子与氯离子结合成难溶性氯 化银,故 D 说法正确。 故选:B。 【点评】解答本题关键是熟悉反应的实质。 7下列物质的用途中,利用其物理性质的是( ) A用生石灰做干燥剂 B用 75%的酒精溶液对皮肤消毒 C用活性炭除去自来水中的异味和色素 D用白醋除去水壶中的水垢 【分析】物理性质是指物质不需要发生化学变化就表现出来的性质。化学性质是指物质在化学变化中表 现出来的性质。而化学变化的本质特征是变化中有新物质生成,因此,判断物理性质还是化学性质的关 键就是看表现物质的性质时是否有新物质产生。 【解答】解:物质的颜色、状态、气味、熔点、沸点、硬度
24、、密度等性质,不需要发生化学变化就表现 出来,因此,都属于物理性质。 A用生石灰做干燥剂,利用生石灰与水反应,属于化学性质; B用 75%的酒精溶液对皮肤消毒,酒精可使蛋白质变性,可用于皮肤消毒,属于化学性质; C用活性炭除去自来水中的异味和色素,利用活性炭的吸附性,属于物理性质; D用白醋除去水壶中的水垢,利用醋酸与碳酸钙反应,属于化学性质。 故选:C。 【点评】物理性质、化学性质是一对与物理变化、化学变化有密切关系的概念,联系物理变化、化学变 化来理解物理性质和化学性质,则掌握起来并不困难。 8如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( ) At1时,甲的饱和溶


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2021 山东省 威海市 中考 化学 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 2021年宁夏中考化学真题含答案解析
- 2017年山东省威海市中考地理试卷含答案解析
- 2021年山东省高考化学真题含答案
- 2021年山东省威海中考英语真题含答案
- 2016年山东省威海市中考化学试卷及答案
- 2021年山东省高考物理真题解析版
- 2020年山东省高考地理真题含答案
- 2017年山东省威海市中考化学试卷含答案解析
- 2021年山东省威海市中考化学真题含答案解析
- 2021年山东省高考生物真题含答案
- 2020年山东省威海市中考历史试卷含答案解析
- 2021年山东省高考历史真题含答案
- 2016年山东省威海市中考地理试卷含答案解析
- 年山东省高考历史真题
- 2020年山东省威海市中考英语试卷含答案解析
- 2020年山东省高考地理真题含答案解析
- 2021年山东省高考地理真题含答案解析
- 2021山东日照中考历史真题
- 威海数学真题



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-187839.html