 浙江省绍兴市2021年中考化学试题(解析版)
浙江省绍兴市2021年中考化学试题(解析版)
《浙江省绍兴市2021年中考化学试题(解析版)》由会员分享,可在线阅读,更多相关《浙江省绍兴市2021年中考化学试题(解析版)(11页珍藏版)》请在七七文库上搜索。
1、 浙江省绍兴市浙江省绍兴市 2021 年中考化学试题年中考化学试题 1. 下列实验操作正确的是 A. 加热液体 B. 加固体药品 C. 滴加液体药品 D. 检验气密性 【答案】D 【解析】 【详解】A、给试管里的液体加热时,应用外焰加热,试管里的液体不能超过试管容积的 1/3,图中操作错 误,不符合题意; B、往试管里装入固体粉末时,为避免药品沾在管口和管壁上,可先使试管倾斜,把盛有药品的药匙(或用 小纸条折叠成的纸槽)小心地送至试管底部,然后使试管直立起来。图中操作错误,不符合题意; C、胶头滴管加液时,既不能伸入容器,更不能接触容器,应垂直悬空于容器上方 0.5cm 处。不符合题意; D、
2、检查气密性:将导管置于水中,用手紧握试管,观察导管口是否有气泡冒出,有气泡冒出,说明气密性 良好,符合题意。 故选 D。 2. 下列科学实验设计方案正确的是 A. 区分铁和硫化亚铁 B. 验证铁钉生锈需 要氧气 C. 干燥并收集一瓶氧气 D. 测定空气中氧 气的体积分数 【答案】A 【解析】 【详解】A、铁能被磁铁吸引,硫酸亚铁不能被磁铁吸引,可以用磁铁吸引区分,符合题意; B、左边试管中铁钉与氧气和水接触,生锈,右边试管中铁钉与氧气接触,不生锈,说明铁生锈需要水,不 符合题意; C、氧气的密度比空气大,用万用瓶收集,应“长进短出”,不符合题意; D、木炭燃烧生成二氧化碳,化学反应前后,压强的
3、变化不大,无法测定空气中氧气的含量,不符合题意。 故选 A。 3. 我国发明的新型钛合金,为“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属 钛的主要反应式是: 3234 2FeTiO +6C+7Cl2FeCl +2TiCl +6CO 一定条件 ; 42 2Mg+TiCl2MgCl +Ti 高温 。下列说法合理的是 A. FeTiO3属于氧化物 B. 钛合金是一种金属单质 C. 反应属于置换反应 D. TiCl4中钛元素和氯元素的质量比为 96:71 【答案】C 【解析】 【详解】A、FeTiO3是由 Fe、Ti、O 三种元素组成,不属于氧化物,不符合题意; B、钛合金是在钛
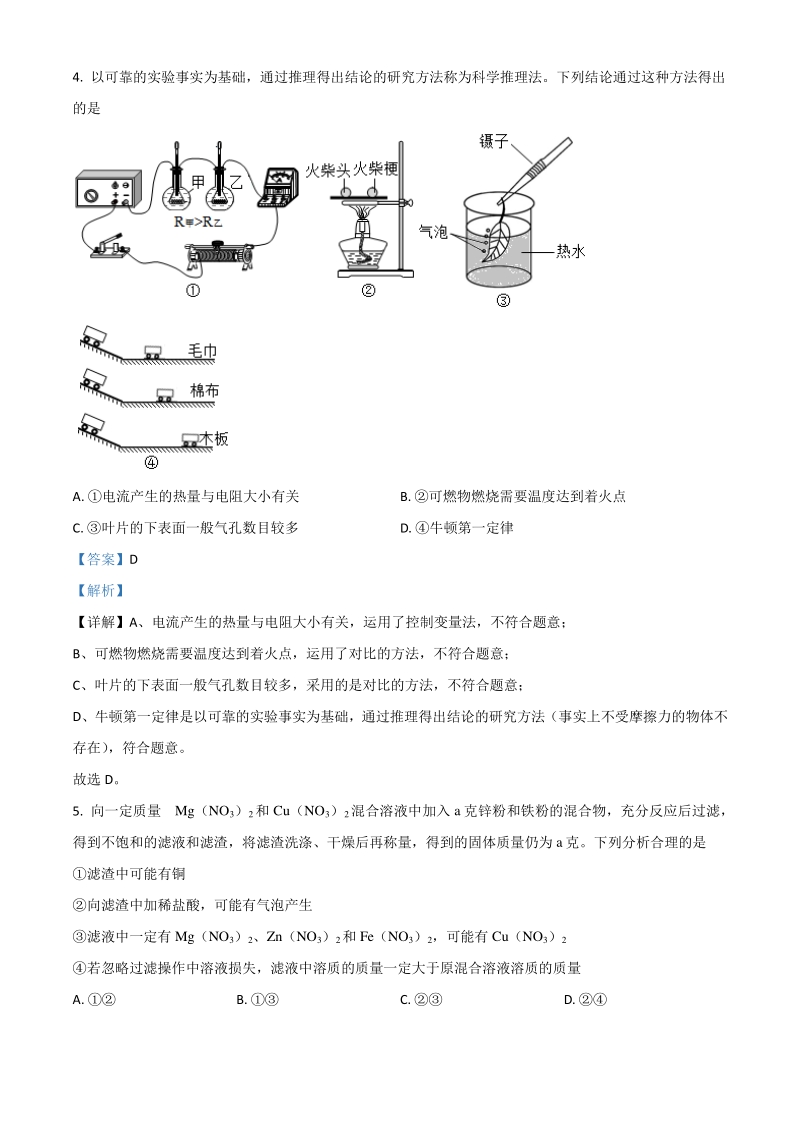
4、中加入其它物质混合而成,不属于单质,属于混合物,不符合题意; C、反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,符合 题意; D、TiCl4中钛元素和氯元素的质量比为:48: (35.54)=24:71,不符合题意。 故选 C。 4. 以可靠的实验事实为基础,通过推理得出结论的研究方法称为科学推理法。下列结论通过这种方法得出 的是 A. 电流产生的热量与电阻大小有关 B. 可燃物燃烧需要温度达到着火点 C. 叶片的下表面一般气孔数目较多 D. 牛顿第一定律 【答案】D 【解析】 【详解】A、电流产生的热量与电阻大小有关,运用了控制变量法,不符合题意; B
5、、可燃物燃烧需要温度达到着火点,运用了对比的方法,不符合题意; C、叶片的下表面一般气孔数目较多,采用的是对比的方法,不符合题意; D、牛顿第一定律是以可靠的实验事实为基础,通过推理得出结论的研究方法(事实上不受摩擦力的物体不 存在) ,符合题意。 故选 D。 5. 向一定质量Mg(NO3)2和 Cu(NO3)2混合溶液中加入 a 克锌粉和铁粉的混合物,充分反应后过滤, 得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为 a克。下列分析合理的是 滤渣中可能有铜 向滤渣中加稀盐酸,可能有气泡产生 滤液中一定有 Mg(NO3)2、Zn(NO3)2和 Fe(NO3)2,可能有 Cu
6、(NO3)2 若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量 A. B. C. D. 【答案】C 【解析】 【详解】金属活动性:MgZnFeCu,向一定质量的硝酸镁和硝酸铜的混合溶液中加入 ag 锌粉和铁粉的 混合物,锌先与硝酸铜反应生成硝酸锌和铜,即: 3 23 2 Zn+Cu(NO )NO+CuZn,65 份的锌置换出 64 份的铜,固体质量减小,溶液质量增加,待硝酸铜完全反应后,铁与硝酸铜反应生成硝酸亚铁和铜,即 3 23 2 Fe+Cu(NO )NO+CuFe,56 份的铁置换出 64 份的铜,固体质量增加,溶液质量减小,充分反应 后过滤,得到不饱和的滤液和滤渣
7、,将滤渣洗涤、干燥后再称量,得到的固体质量仍为 a 克,故一定发生 了铁和硝酸铜的反应。 一定发生了锌和硝酸铜、铁和硝酸铜的反应,滤渣中一定有铜,错误; 铁可能过量,向滤渣中加稀盐酸,可能有气泡产生,正确; 硝酸镁不参与反应,滤液中一定含硝酸镁,锌、铁一定与硝酸铜发生了反应,滤液中一定含硝酸锌和硝 酸亚铁,可能含硝酸铜,正确; 锌与硝酸铜反应,溶液质量增加,铁与硝酸铜反应,溶液质量减小,完全反应后,滤渣的质量不变,故 滤液中溶质的质量等于原混合溶液溶质的质量,错误。 故正确的是。 故选 C。 6. 2021年 3 月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具
8、等 一批珍贵文物,如图。 (1)出土黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜_(选填 “强”或“弱”) 。 (2)古代制作青铜器的铜来源于铜矿,如黄铜矿,黄铜矿的主要成分为二硫化亚铁铜为(CuFeS2) ,其中 铁元素和铜元素均为十 2价,则硫元素的化合价为_。 (3)应用碳-14 测出三星堆遗址距今 3000年左右,碳-12 和碳-14是碳元素的两种同位素原子,它们的主要 区别是原子核中_数不同。 【答案】 (1). 弱 (2). -2 (3). 中子 【解析】 【详解】 (1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜弱,金很 难与其
9、它物质反应; (2)CuFeS2中铁元素显+2 价,铜元素显+2 价,设硫元素的化合价为 x,根据化合物中,正、负化合价的代 数和为零,可得: (+2)+(+2)+2x=0,x=-2; (3)碳-12 和碳-14 是碳元素的两种同位素原子,它们的质子数相同,主要区别是原子核中中子数不同。 7. 物质的溶解度不同,用途也不同。请据表回答: 表一 物质的溶解度(20) 物质 NaOH Ca(OH)2 CaCO3 CaSO3 溶解度(克) 109 0.165 0 0014 0.0043 表二 物质在水中的溶解性等级 20时的溶解度(克) 10 1-10 0.01-1 0.01 等级 易溶 可溶 微溶
10、 难溶 (1)实验中一般用氢氧化钠溶液吸收二氧化碳,而不用澄清石灰水来吸收二氧化碳主要原因是氢氧化钙 _于水,吸收效果不好。 (2)实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的不一定是二氧化 碳,也可能是二氧化硫,请用化学方程式说明_。 (3)20时,饱和氢氧化钠溶液的溶质质量分数为_。 (精确到 0.1%) 【答案】 (1). 微溶 (2). 232 2 SO +Ca OH=CaSO+H O (3). 52.2% 【解析】 【详解】 (1)实验中一般用氢氧化钠溶液吸收二氧化碳,而不用澄清石灰水来吸收二氧化碳主要原因是氢 氧化钙微溶于水,浓度低,吸收二氧化碳的量有
11、限; (2)二氧化硫能与氢氧化钙反应生成亚硫酸钙和水,生成沉淀,该反应的化学方程式为: 2232 SO +Ca(OH) =CaSO+H O; (3)20时,氢氧化钠的溶解度为 109g,饱和氢氧化钠溶液的溶质质量分数为: 109g 100%52.2% 109g 100g 。 8. 酸碱理论的发展如下: 17世纪前,人们对酸碱的认识模糊,只凭感觉器官的感受来判定。 17世纪木,朴素的酸感理论:凡物质的水溶液能溶解某些金属,跟碱接触会失去原有特性,且能使石蕊 试液变红的物质叫酸;凡物质的水溶液有苦溜味,跟酸接触后会失去原有特性,且使石蕊试液变蓝的物质 叫碱。 19世纪末,酸碱电离理论:电离时所生成


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 浙江省 绍兴市 2021 年中 化学试题 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 化学试题
- 江西省2021年中考化学试题解析版
- 湖南省湘潭市2021年中考化学试题解析版
- 江苏省扬州市2021年中考化学试题解析版
- 浙江省宁波市2021年中考化学试题解析版
- 浙江省绍兴市2021年中考化学试题解析版
- 浙江省绍兴市2018年中考化学试卷含答案解析
- 浙江省绍兴市2019年中考语文试卷解析版
- 湖南省常德市2021年中考化学试题解析版
- 浙江省绍兴市2016年中考化学试卷及答案解析
- 浙江省绍兴市2021年中考英语试题解析版
- 湖南省怀化市2021年中考化学试题解析版
- 浙江省嘉兴市2021年中考语文试题解析版
- 2021年浙江省绍兴市中考科学试题含答案
- 湖南省邵阳市2021年中考化学试题解析版
- 湖北省荆州市2021年中考化学试题解析版
- 河北省2021年中考化学试题解析版
- 浙江省嘉兴市2021年中考化学试题解析版
- 浙江省绍兴市2021年中考语文试题含答案
- 绍兴市2022中考语文



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-186475.html