 2021年高考化学二轮专题复习 专题10水溶液中离子反应(讲)
2021年高考化学二轮专题复习 专题10水溶液中离子反应(讲)
《2021年高考化学二轮专题复习 专题10水溶液中离子反应(讲)》由会员分享,可在线阅读,更多相关《2021年高考化学二轮专题复习 专题10水溶液中离子反应(讲)(36页珍藏版)》请在七七文库上搜索。
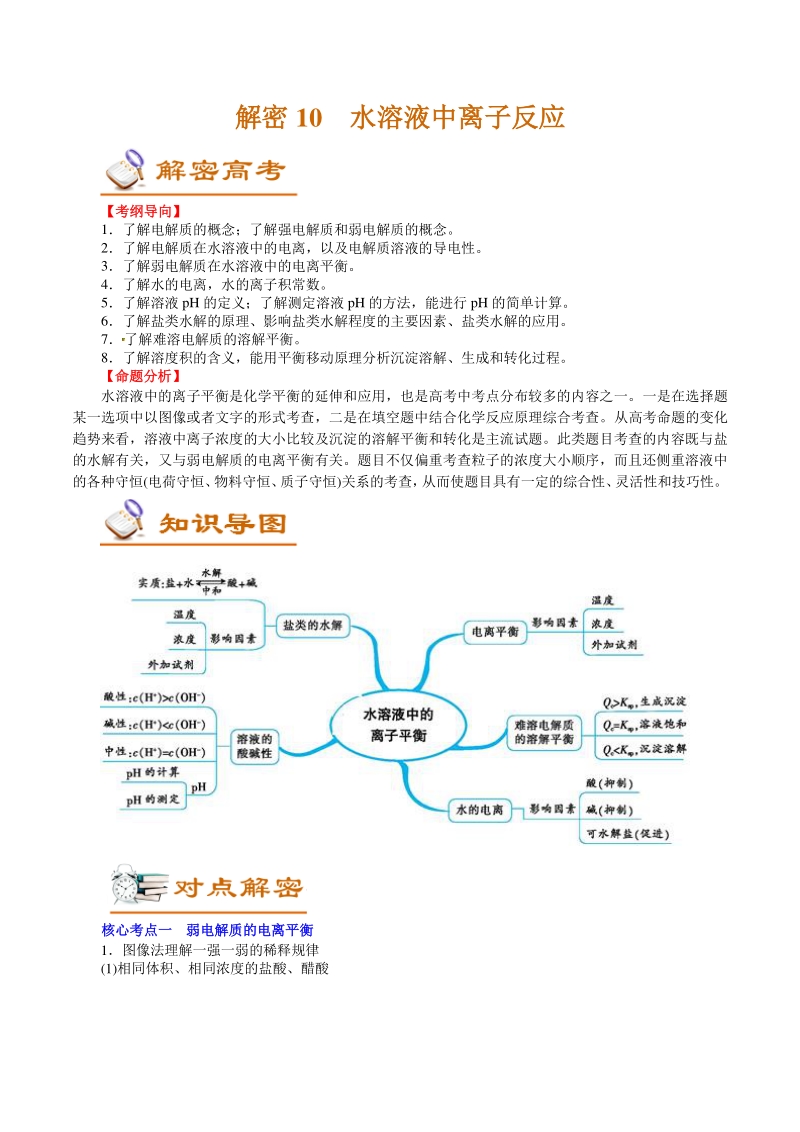
1、解密解密 10 水溶液中离子反应水溶液中离子反应 【考纲导向】【考纲导向】 1了解电解质的概念;了解强电解质和弱电解质的概念。 2了解电解质在水溶液中的电离,以及电解质溶液的导电性。 3了解弱电解质在水溶液中的电离平衡。 4了解水的电离,水的离子积常数。 5了解溶液 pH 的定义;了解测定溶液 pH 的方法,能进行 pH 的简单计算。 6了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。 7了解难溶电解质的溶解平衡。 8了解溶度积的含义,能用平衡移动原理分析沉淀溶解、生成和转化过程。 【命题分析命题分析】 水溶液中的离子平衡是化学平衡的延伸和应用,也是高考中考点分布较多的内容之一
2、。一是在选择题 某一选项中以图像或者文字的形式考查,二是在填空题中结合化学反应原理综合考查。从高考命题的变化 趋势来看,溶液中离子浓度的大小比较及沉淀的溶解平衡和转化是主流试题。此类题目考查的内容既与盐 的水解有关,又与弱电解质的电离平衡有关。题目不仅偏重考查粒子的浓度大小顺序,而且还侧重溶液中 的各种守恒(电荷守恒、 物料守恒、 质子守恒)关系的考查, 从而使题目具有一定的综合性、 灵活性和技巧性。 核心考点一核心考点一 弱电解质的电离平衡弱电解质的电离平衡 1图像法理解一强一弱的稀释规律 (1)相同体积、相同浓度的盐酸、醋酸 a加水稀释相同的倍数,醋酸的 pH 大。 b加水稀释到相同的 p
3、H,盐酸加入的水多。 (2)相同体积、相同 pH 值的盐酸、醋酸 a加水稀释相同的倍数,盐酸的 pH 大。 b加水稀释到相同的 pH,醋酸加入的水多。 2有关电离平衡常数计算答题模板(以弱酸 HX 为例) HX H X 起始/(mol L 1): c(HX) 0 0 平衡/(mol L 1): c(HX)c(H) c(H ) c(H) 则 K c2H cHXcH 由于弱酸只有极少一部分电离,c(H )的数值很小,可做近似处理:c(HX)c(H)c(HX)。 则 Kc 2 H cHX 或 c(H ) K c HX。 3弱电解质平衡移动的“三个不一定” (1)稀醋酸加水稀释时,溶液中不一定所有的离
4、子浓度都减小。因为温度不变,Kwc(H ) c(OH)是定 值,稀醋酸加水稀释时,溶液中的 c(H )减小,故 c(OH)增大。 (2)电离平衡右移,电解质分子的浓度不一定减小,离子的浓度不一定增大,电离程度也不一定增大。 (3)对于浓的弱电解质溶液加 H2O 稀释的过程, 弱电解质的电离程度逐渐增大, 但离子浓度不一定减小, 可能先增大后减小。 4一元强酸与一元弱酸的比较 等物质的量浓度的盐酸 (a)与醋酸溶液(b) 等 pH 的盐酸(a)与醋酸溶液(b) pH 或物质的量浓度 pH:ab 物质的量浓度:ab 溶液的导电性 ab ab 水的电离程度 ab ab 加水稀释等倍数 pH 的变化量
5、 ab ab 等体积溶液中和 NaOH 反应的量 ab ab 分别加该酸的钠盐固体后 pH a:不变;b:变大 a:不变;b:变大 开始与金属反应的速率 ab 相同 等体积溶液与过量活泼金属产生 H2的量 相同 ab 5一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较 (1)相同体积、相同浓度的盐酸、醋酸 加水稀释相同的倍数,醋酸的 pH 大 加水稀释到相同的 pH,盐酸加入的水多 (2)相同体积、相同 pH 值的盐酸、醋酸 加水稀释相同的倍数, 盐酸的 pH 大 加水稀释到相同的 pH, 醋酸加入的水多 考法一考法一 判断电解质强弱判断电解质强弱 【典例【典例 1】(2021 年
6、1 月浙江选考)下列物质属于强电解质的是( ) AKOH BH3PO4 CSO3 DCH3CHO 【解析】在水溶液中或熔融状态下能够完全电离的化合物为强电解质。A 项,KOH 在水溶液中或熔融 状态下能够完全电离出 K+和 OH-,KOH 为强电解质,A 符合题意;B 项,H3PO4在水溶液中或熔融状态下 能不够完全电离,H3PO4为弱电解质,B 不符合题意;C 项,SO3在水溶液中或熔融状态下不能电离,SO3 属于非电解质,C 不符合题意;D 项,CH3CHO 在水溶液中或熔融状态下不能电离,CH3CHO 属于非电解 质,D 不符合题意;故选 A。 【答案】A 考法二考法二 弱酸弱酸(碱碱)
7、或弱碱或弱碱(酸酸)的比较的比较 【典例【典例 2】下列事实中不能证明 CH3COOH 是弱电解质的是( ) A.常温下某 CH3COONa 溶液的 pH8 B.常温下 0.1 mol L 1CH 3COOH 溶液的 pH28 C.CH3COONa 溶液与稀盐酸反应生成 CH3COOH 和 NaCl D.CH3COOH 属于共价化合物 【解析】 A项, 常温下某CH3COONa溶液的pH8, CH3COONa水解显碱性, 为弱酸强碱盐, 故CH3COOH 为弱电解质,正确;B 项,常温下 0.1 mol L 1CH 3COOH 溶液的 pH28,说明 CH3COOH 部分电离,为 弱电解质,正
8、确;C 项,根据强酸制弱酸的原理,盐酸制取了醋酸,所以醋酸为弱酸,是弱电解质,正确; D 项,强电解质和弱电解质都有可能为共价化合物,错误。 【答案】D 考法三考法三 电解质稀释图象电解质稀释图象 【典例【典例 3】(2019天津卷)某温度下,HNO2和 CH3COOH 的电离常数分别为 50 10 4和 17 105。 将 pH 和体积均相同的两种酸溶液分别稀释,其 pH 随加水体积的变化如图所示。下列叙述正确的是( ) A 曲线代表 HNO2溶液 B 溶液中水的电离程度:b 点c 点 C 从 c 点到 d 点,溶液中 HAOH A cc c 保持不变(其中HA、A分别代表相应的酸和酸根离子
9、) D 相同体积 a 点的两溶液分别与NaOH恰好中和后,溶液中 Nan 相同 【解析】A、由图可知,稀释相同的倍数,的变化大,则的酸性比 I 的酸性强,代表 HNO2,I 代表 CH3COOH,故 A 错误;B、酸抑制水电离,b 点 pH 小,酸性强,对水电离抑制程度大,故 B 错误;C、 代表 HNO2,c(HNO2)c(OH-)/c(NO2-)=c(H+) c(HNO2)c(OH-)/c(H+) c(NO2-)=kw/k(HNO2),kw 为水的离子积常 数,k(HNO2)为 HNO2的电离常数,只与温度有关,温度不变,则不变,故 C 正确;D、体积和 pH 均相同 的 HNO2和 CH
10、3COOH 溶液,c(CH3COOH)c(HNO2),分别滴加同浓度的 NaOH 溶液至中性,CH3COOH 消耗的氢氧化钠溶液体积多,HNO2消耗的 NaOH 少,故 D 错误;故选 C。 【答案】C 考法四考法四 电离平衡常数电离平衡常数 【典例【典例 4】 (2021 年 1 月浙江选考)实验测得 10 mL 0.50 mol L- 1NH4Cl 溶液、 10 mL 0.50mol L- 1CH3COONa 溶液的 pH 分别随温度与稀释加水量的变化如图所示。 已知 25 时 CH3COOH 和 NH3 H2O 的电离常数均为 18 10- 5下列说法不正确 的是( ) A图中实线 表示
11、 pH 随加水量的变化,虚线 表示 pH 随温度的变化 B将 NH4Cl 溶液加水稀释至浓度 0.50 x mol L- 1,溶液 pH 变化值小于 lgx C随温度升高,Kw增大,CH3COONa 溶液中 c(OH- )减小,c(H+)增大,pH 减小 D25 时稀释相同倍数的 NH4Cl 溶液与 CH3COONa 溶液中:c(Na+ )- c(CH3COO- )=c(Cl-)- c(NH4+) 【解析】由题中信息可知,图中两条曲线为 10 mL 0. 50 mol L- 1 NH4Cl 溶液、10 mL 0.50mol L- 1CH3COONa 溶液的 pH 分别随温度与稀释加水量的变化曲
12、线,由于两种盐均能水解,水解反应为 吸热过程,且温度越高、浓度越小其水解程度越大。氯化铵水解能使溶液呈酸性,浓度越小,虽然水程度 越大, 但其溶液的酸性越弱, 故其 pH 越大; 醋酸钠水解能使溶液呈碱性, 浓度越小, 其水溶液的碱性越弱, 故其 pH 越小。温度越高,水的电离度越大。因此,图中的实线为 pH 随加水量的变化,虚线表示 pH 随温 度的变化。A 项,由分析可知,图中实线表示 pH 随加水量的变化,虚线表示 pH 随温度的变化,A 说法正 确; B 项, 将 NH4Cl 溶液加水稀释至浓度 0.50 x mol L- 1时, 若氯化铵的水解平衡不发生移动, 则其中的 c(H+)
13、变为原来的 1 x ,则溶液的 pH 将增大 lgx,但是,加水稀释时,氯化铵的水解平衡向正反应方向移动,c(H+) 大于原来的 1 x ,因此,溶液 pH 的变化值小于 lgx,B 说法正确;C 项,随温度升高,水的电离程度变大, 因此水的离子积变大,即 Kw增大;随温度升高,CH3COONa 的水解程度变大,溶液中 c(OH-)增大,因此, C说法不正确; D项, 25时稀释相同倍数的NH4C1溶液与CH3COONa溶液中均分别存在电荷守恒, c(Na+ ) +c(H+) =c(OH-)+c(CH3COO- ) ,c(NH4+)+c(H+ ) =c(Cl-)+c(OH- )。因此,氯化铵溶
14、液中,c(Cl-)- c(NH4+) =c(H+ )- c(OH- ),醋酸钠溶液中,c(Na+ )- c(CH3COO- )= c(OH-) - c(H+) 。由于 25 时 CH3COOH 和 NH3 H2O 的电离常数均为 18 10- 5,因此,由于原溶液的物质的量浓度相同,稀释相同倍数后的 NH4C1 溶液与 CH3COONa 溶液,溶质的物质的量浓度仍相等,由于电离常数相同,其中盐的水解程度是相同的,因此, 两溶液中c(OH-) - c(H+)(两者差的绝对值)相等, 故 c(Na+ )- c(CH3COO- )=c(Cl-)- c(NH4+), D 说法正确。 故选 C。 【答案
15、】C 考法五考法五 电离平衡常数的理解和应用电离平衡常数的理解和应用 【典例【典例 5】 硫酸、 硝酸、 高氯酸在水溶液中都是强酸, 下表是某温度下这三种酸在冰醋酸中的电离常数。 下列说法正确的是( ) 酸 H2SO4 HNO3 HClO4 K1 63 10 9 42 10 10 16 10 5 A.在冰醋酸中 H2SO4的电离方程式为:H2SO42H SO2 4 B.在冰醋酸中,HNO3的酸性最强 C.在冰醋酸中,0.01 mol/L 的 HClO4,其离子总浓度约为 4 10 4mol/L D.高氯酸水溶液与氨水反应的离子方程式为 H NH 3 H2O=H2ONH 4 【解析】在冰醋酸中,
16、H2SO4分步电离,其第一步电离方程式为 H2SO4H HSO 4,A 项错误; 根据在冰醋酸中的电离常数, 三种酸的酸性强弱顺序为 HClO4H2SO4HNO3, B 项错误; 设在冰醋酸中 0.01 mol/L 的 HClO4的 H 物质的量浓度为 xmol L1, HClO4 H ClO 4 c(起始)/mol/L 0.01 0 0 c(变化)/mol/L x x x c(平衡)/mol/L 0.01 x x x 则电离常数 K x2 0.01x x2 0.011 6 10 5, x4 104 mol/L, 离子总浓度约为 8 104 mol/L, C 项错误; 在水溶液中,HClO4是
17、一元强酸,NH3 H2O 是一元弱碱,D 项正确。 【答案】D 以一元强酸(HCl)与一元弱酸(CH3COOH)的比较为例 (1)相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较 比较项比较项 目目 酸 c(H ) pH 中和碱的能 力 与活泼金属反应产 生 H2的量 开始与金属反 应的速率 盐酸 大 小 相同 相同 大 醋酸溶液 小 大 小 (2)相同 pH、相同体积的盐酸与醋酸溶液的比较 比较 项目 酸 c(H ) c(酸) 中和碱的 能力 与足量活泼金属反 应产生 H2的量 开始与金属反 应的速率 盐酸 相同 小 小 少 相同 醋酸溶液 大 大 多 1(2019浙江 4 月选考)下列属于
18、强电解质的是( ) A 硫酸钡 B 食盐水 C 二氧化硅 D 醋酸 【答案】A 【解析】A 项,可知硫酸钡是强电解质,A 项正确;B 项,食盐水为混合物,不在强电解质的概念内, B 项错误;C 项,二氧化硅是非电解质,C 项错误;D 项,醋酸在水中不完全电离,为弱电解质,D 项错误。 2下列事实能说明亚硫酸的酸性强于碳酸的是( ) A.饱和亚硫酸溶液的 pH 小于饱和碳酸溶液的 pH B.亚硫酸能使酸性高锰酸钾溶液褪色,而碳酸不能 C.同温下,等浓度的亚硫酸氢钠溶液和碳酸氢钠溶液,碳酸氢钠溶液的碱性强 D.将过量二氧化硫气体通入碳酸氢钠溶液中,逸出的气体能使澄清石灰水变浑浊 【答案】C 【解析
19、】由于亚硫酸饱和溶液和碳酸饱和溶液的浓度不相等,因此不能根据二者饱和溶液的 pH 比较其 酸性强弱,A 项错误;亚硫酸使酸性高锰酸钾溶液褪色是因为其具有还原性,与酸性强弱无关,B 项错误; 同温、 等浓度条件下, 碳酸氢钠溶液的碱性强, 即 HCO 3的水解程度大, 说明其对应酸的酸性弱, C 项正确; 反应生成的 CO2和过量的 SO2均能使澄清石灰水变浑浊,故不能确定是否生成 CO2,即不能比较 H2SO3和 H2CO3的酸性强弱,D 项错误。 3 常温下 pH2 的两种酸溶液 A 和 B, 分别加水稀释 1 000 倍, 其 pH 与所加水的体积变化如图所示。 下列结论正确的是( ) A
20、.B 酸比 A 酸的电离度大 B.A 为弱酸,B 为强酸 C.B 酸的物质的量浓度比 A 的小 D.A 酸比 B 酸易电离 【答案】D 【解析】根据图示可知溶液稀释 1 000 倍后,A 酸溶液 pH 变化大,说明 A 酸酸性大于 B 酸酸性。则 B 酸为弱酸,其电离度应比 A 酸小,A 酸易电离。同为 pH2,B 酸溶液物质的量浓度一定比 A 酸溶液浓度 大。 4室温下,将 1000 mL 5000 0 mol L 1 醋酸滴入 100.00 mL 蒸馏水中,溶液中 c(H )和温度随着加 入醋酸体积的变化曲线如图所示,下列有关说法正确的是( ) Aab 段,醋酸电离过程为放热过程 Bcd
21、段,c(H )增加,醋酸电离程度增大 Cc 点时,加入等体积等浓度的 NaOH 溶液,则 c(Na )c(CH 3COO )c(CH 3COOH) Dd 点时,c(H )c(CH 3COOH) 【答案】C 【解析】ab 段,醋酸电离过程为吸热过程,电解质溶于水,扩散过程(电离)吸热,水合过程(形成水 合离子)放热,A 错误;cd 段,醋酸浓度增大,c(H )增加,醋酸电离程度减小,B 错误;c 点时,加入等 体积等浓度的 NaOH 溶液,根据物料守恒,有 c(Na )c(CH 3COO )c(CH 3COOH), C 正确;醋酸是弱酸, 电离是微弱的,在溶液中主要以分子的形式存在,故 d 点时
22、,c(H )c(CH 3COOH),D 错误。 5已知 25 下,醋酸溶液中各粒子存在下述关系:Kc(CH3COO ) c(H) c(CH3COOH) 175 10 5,下列 有关说法可能成立的是( ) A.25 下,向该溶液中加入一定量的盐酸时,K8 10 5 B.25 下,向该溶液中加入一定量的盐酸时,K8 10 4 C.标准状况下,醋酸溶液中 K175 10 5 D.升高到一定温度,K72 10 5 【答案】D 【解析】K 为醋酸的电离常数,只与温度有关,与离子浓度无关,故 A、B 两项均错误;由于醋酸电离 过程吸热,则升高温度,K 增大,降低温度,K 减小,所以标准状况下(0 ),K
23、应小于 175 10 5,C 项 错误;升高温度,K 应大于 175 10 5,D 项正确。 6 已知某温度下 CH3COOH 和 NH3 H2O 的电离常数相等, 现向 10 mL 浓度为 0.1 mol L 1 的 CH3COOH 溶液中滴加相同浓度的氨水,在滴加过程中( ) A.水的电离程度始终增大 B.c(NH 4)/c(NH3 H2O)先增大再减小 C.c(CH3COOH)与 c(CH3COO )之和始终保持不变 D.当加入氨水的体积为 10 mL 时,c(NH 4)c(CH3COO ) 【答案】D 【解析】开始滴加氨水时,水的电离程度增大,二者恰好完全反应时,水的电离程度最大,再继
24、续滴 加氨水时,水的电离程度减小,A 项错误;向醋酸中滴加氨水,溶液的酸性减弱,碱性增强,c(OH )增大, 由 NH3 H2ONH 4 OH 可 知 K c(NH 4) c(OH ) c(NH3 H2O) , 则 c(NH 4) c(NH3 H2O) K c(OH ), 故 c(NH 4) c(NH3 H2O)减小,B 项错误;根据原子守恒知 n(CH3COO )与 n(CH 3COOH)之和不变,但滴加氨水过程 中,溶液体积不断增大,故 c(CH3COO )与 c(CH 3COOH)之和减小,C 项错误;由 CH3COOH 和 NH3 H2O 的电离常数相等可知当二者恰好完全反应时, 溶液


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2021年高考化学二轮专题复习 专题10 水溶液中离子反应讲 2021 年高 化学 二轮 专题 复习 10 水溶液 离子 反应
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-182769.html