 第3部分 第13讲 元素的循环和物质的转化—2021届浙教版中考科学一轮复习巩固练习
第3部分 第13讲 元素的循环和物质的转化—2021届浙教版中考科学一轮复习巩固练习
《第3部分 第13讲 元素的循环和物质的转化—2021届浙教版中考科学一轮复习巩固练习》由会员分享,可在线阅读,更多相关《第3部分 第13讲 元素的循环和物质的转化—2021届浙教版中考科学一轮复习巩固练习(11页珍藏版)》请在七七文库上搜索。
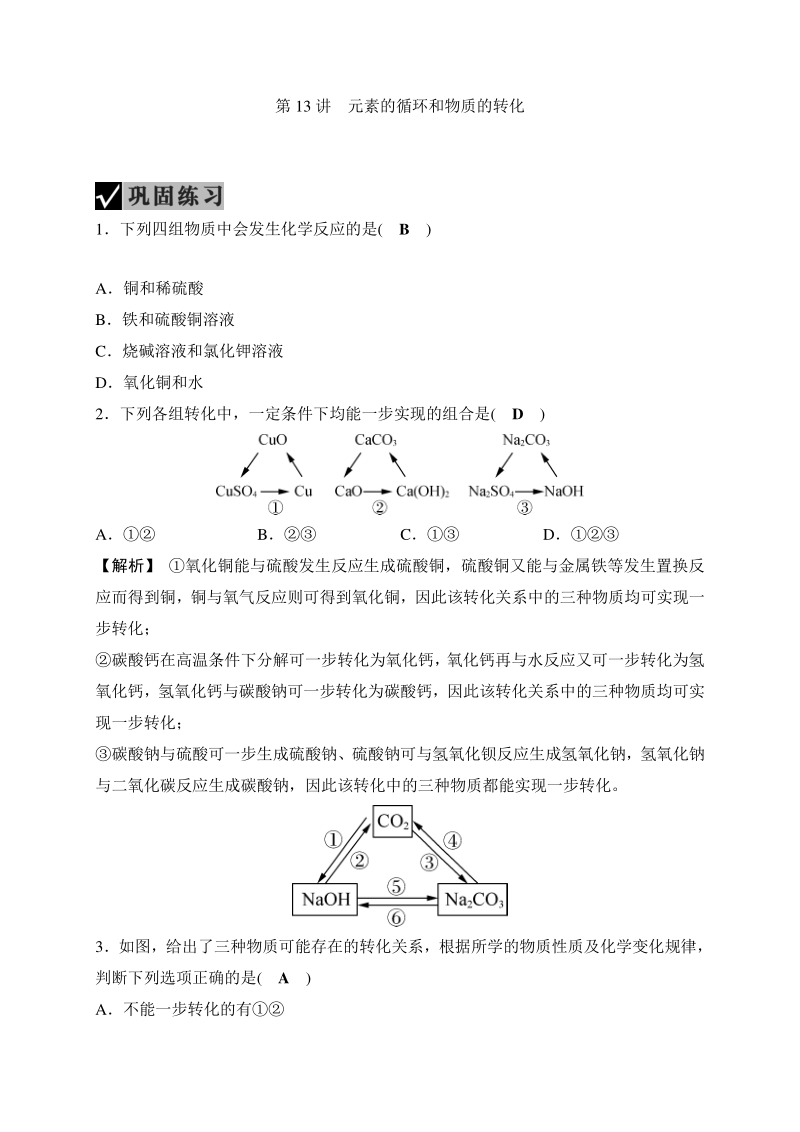
1、第 13 讲 元素的循环和物质的转化 1下列四组物质中会发生化学反应的是( B ) A铜和稀硫酸 B铁和硫酸铜溶液 C烧碱溶液和氯化钾溶液 D氧化铜和水 2下列各组转化中,一定条件下均能一步实现的组合是( D ) A B C D 【解析】 氧化铜能与硫酸发生反应生成硫酸铜,硫酸铜又能与金属铁等发生置换反 应而得到铜,铜与氧气反应则可得到氧化铜,因此该转化关系中的三种物质均可实现一 步转化; 碳酸钙在高温条件下分解可一步转化为氧化钙, 氧化钙再与水反应又可一步转化为氢 氧化钙,氢氧化钙与碳酸钠可一步转化为碳酸钙,因此该转化关系中的三种物质均可实 现一步转化; 碳酸钠与硫酸可一步生成硫酸钠、硫酸钠
2、可与氢氧化钡反应生成氢氧化钠,氢氧化钠 与二氧化碳反应生成碳酸钠,因此该转化中的三种物质都能实现一步转化。 3如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律, 判断下列选项正确的是( A ) A不能一步转化的有 B实现转化,可通至氯化钠溶液 C实现转化,可加入碳酸钙粉末 D实现转化,可加入氢氧化钾溶液 4如图是小柯同学在复习科学时,构建酸通性的“手掌图”,其中五个手指表示能与 酸发生化学反应的五类物质。 (1)无名指上漏填的一类物质是 _碱_。 (2)若利用铜来制取硫酸铜,常用的方法是:铜 步骤氧化铜 步骤硫酸铜。请你写出步 骤反应的化学方程式_CuOH_2SO4_=
3、CuSO4H2O_。 【解析】 (1)碱能与酸反应生成盐和水。(2)氧化铜与硫酸反应生成硫酸铜和水。 5某同学设计了一套验证碳酸具有酸性而二氧化碳没有酸性的实验。他首先用紫色石 蕊试液浸泡滤纸,晒干后折成纸花,然后按下图所示分别进行实验: (1)往紫色石蕊纸花上喷稀醋酸,紫色石蕊纸花显_红_色。 (2)在 B 实验中,当加入水后,紫色石蕊纸花显_紫(或不变色)_色,B 实验的作用是_ 作对比实验_。 (3)在 C 实验中,紫色石蕊纸花变_红_色,这一实验结果说明_C 中有碳酸(酸)使紫色 石蕊变成红色_。 (4)通过以上实验,尚未达到验证的目的,若要达到验证的目的,你的方法是_在 A 装 置中
4、通二氧化碳_。 【解析】 (1)酸能使石蕊变红色,碱能使石蕊变蓝色,中性的物质不能使石蕊变色,水 呈中性,不能使石蕊试纸变红色。 (2)二氧化碳和水反应生成碳酸,碳酸能使石蕊变红色。 (3)B 实验验证了水不能使石蕊试纸变红色, C 实验验证了二氧化碳和水反应生成的碳酸 使石蕊试纸变红色,A 验证了空气的成分不能使石蕊试纸变红色但空气中二氧化碳的含 量较少,故没有验证二氧化碳能否使石蕊变红色。 6如图为生物圈中“碳氧平衡”示意图。请据图回答: (1)图中代表光合作用的生理过程是_A_(填“A”或“B”)。 (2)能够消耗大气中氧气的生理过程是_B_(填“A”或“B”)。 (3)下列叙述不符合事
5、实的是_C_。 A碳氧平衡是指生物圈中二氧化碳和氧气的相对平衡 B植物的光合作用吸收二氧化碳,有利于生物圈中的碳氧平衡 C生物圈中二氧化碳和氧气的含量各占 50%并保持不变 D人类生活和工业生产加剧了生物圈中二氧化碳的排放 (4)在维持生物圈“碳氧平衡”方面,我们可以做些什么?_多植树造林_。 【解析】 (1)图中 A 是绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存能 量的有机物,并且释放出氧气的过程,是光合作用的过程;绿色植物通过光合作用不断 消耗大气中的二氧化碳,维持了生物圈中二氧化碳和氧气的相对平衡。 (2)图中 B 是细胞内的有机物在氧气的参与下被分解成二氧化碳和水,同时释放
6、出能量 的过程,是呼吸作用的过程。 (3)A.绿色植物不断地进行光合作用,消耗大气中的二氧化碳,产生的氧又以气体的形式 进入大气,这样就使得生物圈中的氧气和二氧化碳的浓度处于相对的平衡状态,简称碳 氧平衡。 所以说, 是光合作用维持了大气中的氧气和二氧化碳的平衡。 故 A 说法正确。 B植物的光合作用吸收二氧化碳,有利于生物圈中的碳氧平衡,故 B 说法正确。 C大气中的氧气占空气体积的 21%,二氧化碳占 0.03%,所以碳氧平衡是指生物圈 中二氧化碳和氧气各占 50%是错误的。 D工业生产使用大量的化石燃料,造成二氧化碳排放加剧,故 D 说法正确。 (4)绿色植物通过光合作用不断消耗大气中的
7、二氧化碳, 维持了生物圈中二氧化碳和氧气 的相对平衡,所以在维持生物圈碳氧平衡方面,人类可以多植树造林。 7右图表示 NaCl、Na2CO3、AgNO3、BaCl2、HCl 五种溶液之间的部分反应关系,线 条相连的溶液之间可以发生化学反应。 (1)图中还缺少一条连线,此线应连在_DB_(填字母)两溶液之间。 (2)E 是_NaCl_溶液。 (3)A 和 B 反应有气体生成,则 C 是_BaCl2_溶液。 【解析】 根据酸、碱、盐的性质可知,所给物质两两反应,氯化钠只能与硝酸银反应 为突破口,故 E 为氯化钠;D 为硝酸银;A 为盐酸;B 为碳酸钠;C 为氯化钡; (1)图中还缺少一条连线,此线
8、应连在 B、D 两溶液之间; (2)E 是氯化钠溶液; (3)A 和 B 反应有气体生成,则 C 是氯化钡。 8对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的化学性质 后,初步归纳出稀硫酸与其他物质相互反应的关系如图所示(“”表示相连的两种物 质能发生反应,五个圈中的物质属于不同的类别)。 (1)已知 X 是金属单质,则 X 可以是_Zn、Fe 等活泼金属_(填一种即可)。 (2)请写出稀硫酸与 Y 反应的一个化学方程式_H2SO4BaCl2=BaSO42HCl_。 【解析】 (1)酸能与活泼金属反应,已知 X 是金属单质,则 X 可以是锌、铁等金属。(2) 由题意,五个圈中
9、的物质属于不同的类别,氧化铜属于金属氧化物,氢氧化钠属于碱, X 为金属,则 Y 应为盐,硫酸能与氯化钡溶液反应生成硫酸钡沉淀和盐酸,反应的化学 方程式为 BaCl2H2SO4=BaSO42HCl(合理即可)。 9已知 AI 均为初中科学常见的物质,其中组成 A、C 两种气体的元素相同,且 C 是 常见的温室气体,B 是铁锈的主要成分,D 是单质,F 是盐酸盐。根据如图所示的转化 关系(图中反应条件均已略去)回答下列问题: (1)D 的化学式为_Fe_。 (2)写出反应的化学方程式_Fe2O36HCl=2FeCl33H2O_。 (3)若反应在植物体内进行,这个过程中能量的转化形式是_光能转化为
10、化学能_。 【解析】 组成 A、C 两种气体的元素相同,且 C 是常见的温室气体,则 C 为二氧化碳, 则 A 为一氧化碳;B 是铁锈的主要成分,则 B 为氧化铁,一氧化碳与氧化铁在高温下 反应生成铁和二氧化碳,则 D 为铁;氧化铁与 E 反应生成的 F 是盐酸盐,结合金属氧 化物能与酸反应,则 E 为稀盐酸,G 为水;二氧化碳与水发生光合作用生成葡萄糖和氧 气。 (1)D 的化学式为 Fe。 (2)反应,即氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3 6HCl=2FeCl33H2O。 (3)反应在植物体内进行,即二氧化碳与水发生光合作用生成葡萄糖和氧气,这个 过程中能量的
11、转化形式为光能转化为化学能。 10如图为酸、碱的化学性质知识网络,A、B、C、D 是四种常见的不同类别的无机化 合物,图中短线表示两种物质在一定条件下可以发生化学反应。请你据图回答。 (1)A、 B、 C 三种物质中, 能用来鉴别稀硫酸与氢氧化钙溶液的物质是_Cu(OH)2、 CO2(或 相应名称,或“A、B”)_。 (2)能同时实现反应和的物质可以是_Na2CO3(碳酸钠)_, 反应的实验现象为_ 有气泡(气体)产生_。 【解析】 (1)A、B、C 三种物质中,Cu(OH)2能与稀硫酸反应形成蓝色溶液而与氢氧化 钙溶液不发生反应; CO2通入氢氧化钙溶液能生成白色沉淀而与稀硫酸不发生反应;
12、HCl 与氢氧化钙溶液发生反应无明显现象,与稀硫酸不反应;故能用来鉴别稀硫酸与氢氧化 钙溶液的物质是 Cu(OH)2、CO2。 (2)碳酸钠既可与稀硫酸反应又可与氢氧化钙溶液反应, 所以能同时实现反应和的物 质可以是 Na2CO3(碳酸钠);碳酸钠与稀硫酸反应会生成二氧化碳气体,所以反应的实 验现象为有气泡(气体)产生。 11小科以化合价为纵坐标,以物质类别为横坐标绘制了右图,每种物质中都有一种元 素的化合价与纵坐标的数值对应,图中字母均表示初中科学中的常见物质,其中“” 表示物质间的转化关系。已知 A 中氧元素的质量分数为 60%,C、D、E、F 均含有铜元 素。请回答: (1)“AH2O=


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 第3部分 第13讲元素的循环和物质的转化2021届浙教版中考科学一轮复习巩固练习 部分 13 元素 循环 物质 转化 2021 届浙教版 中考 科学 一轮 复习 巩固 练习
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-180172.html