 2021年浙江温州中考科学复习专题专练13:酸碱盐(含答案解析)
2021年浙江温州中考科学复习专题专练13:酸碱盐(含答案解析)
《2021年浙江温州中考科学复习专题专练13:酸碱盐(含答案解析)》由会员分享,可在线阅读,更多相关《2021年浙江温州中考科学复习专题专练13:酸碱盐(含答案解析)(22页珍藏版)》请在七七文库上搜索。
1、专题专题 13 酸碱盐酸碱盐 一选择题(共一选择题(共 14 小题)小题) 1 (2020 秋温州期中)如图气密性良好的装置,当胶头滴管中的液体加入时,小气球明显鼓起来,过 4 个 小时后,气球无法恢复原状,则使用的固体和液体可以是( ) A硝酸铵和水 B铁和稀硫酸 C固体氢氧化钠和水 D氯化钠和稀盐酸 2 (2020温州)新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是( ) A柠檬汁 B苹果汁 C西瓜汁 D玉米汁 3 (2020瓯海区二模)下表是一些食物的 pH,胃酸过多的病人空腹时最宜食用的是( ) 物质 玉米粥 牛奶 葡萄 橘子 pH 6.88.0 6.36.6 3.54.5 34 A玉
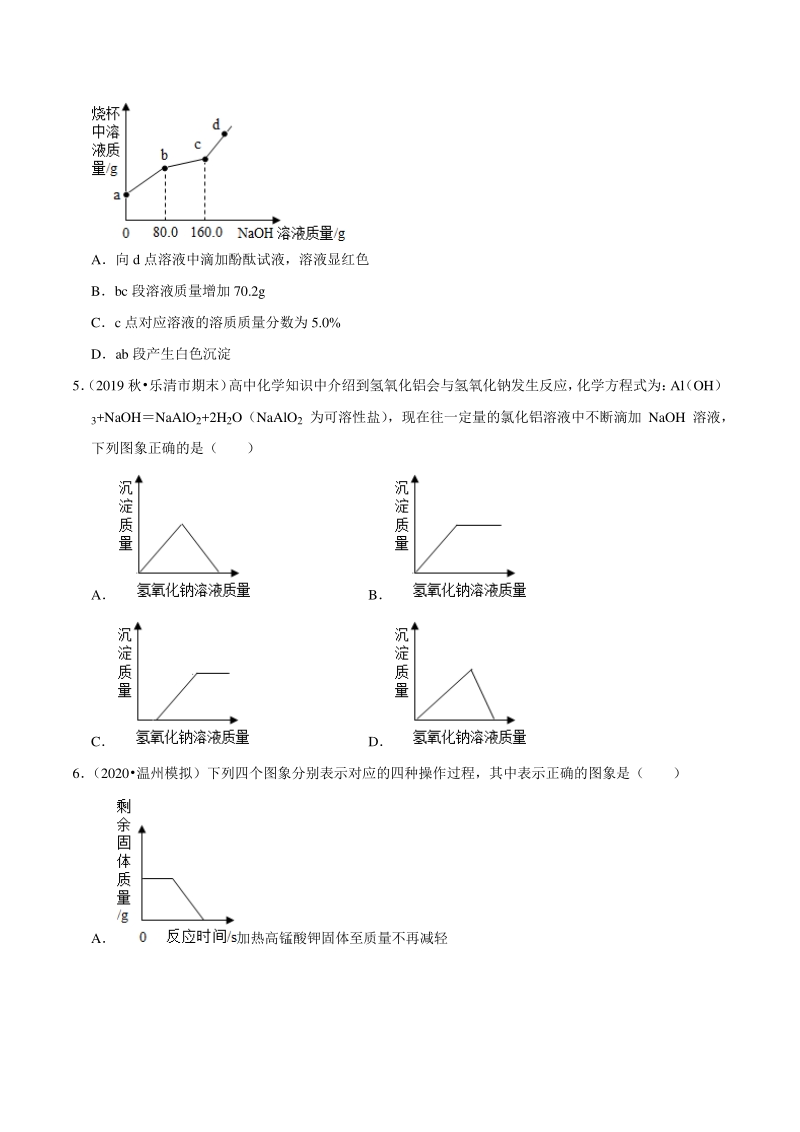
2、米粥 B牛奶 C葡萄 D橘子 4 (2020 秋温州月考)烧杯中盛有 MgCl2和 HCl 的混合溶液 100.0g,向其中滴加溶质质量分数为 10.0% 的 NaOH 溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法正确的是( ) A向 d 点溶液中滴加酚酞试液,溶液显红色 Bbc 段溶液质量增加 70.2g Cc 点对应溶液的溶质质量分数为 5.0% Dab 段产生白色沉淀 5(2019 秋乐清市期末) 高中化学知识中介绍到氢氧化铝会与氢氧化钠发生反应, 化学方程式为: Al (OH) 3+NaOHNaAlO2+2H2O(NaAlO2 为可溶性盐) ,现在往一定量的氯化铝溶液中
3、不断滴加 NaOH 溶液, 下列图象正确的是( ) A B C D 6 (2020温州模拟)下列四个图象分别表示对应的四种操作过程,其中表示正确的图象是( ) A加热高锰酸钾固体至质量不再减轻 B向 pH1 的硫酸溶液中逐滴加入 pH13 的氢氧化钠溶液 C某温度下,向一定量的水中持续加入食盐并不断搅拌 D等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量 M 与反应时间 t 的关 系图 7 (2019 秋温州月考)如图所示装置气密性良好、要使注射器中的活塞向右移动,使用的液体 M 和固体 N 可能是( ) 盐酸和石灰石 稀硫酸和锌 水和固体氢氧化钠 双氧水和二氧化锰 A B C D 8 (20
4、19 秋鹿城区校级月考)在氧化铁金属锌氢氧化铜氢化钡溶液四种物质中跟稀硫酸都能发 生反应其中反应中没有表现“酸的通性”的是( ) A B C D 9 (2019 秋温州月考)在进行氧化铜与稀盐酸反应时,小永将一定量的氧化铜粉末放在烧杯中,再缓缓加 入稀盐酸,烧杯内溶液总质量随加入的稀盐酸的质量变化曲线如图所示。下列各点对应溶液中铜元素质 量相等的是( ) Aa 和 b Bb 和 n Cn 和 m Da 和 m 10 (2019 秋富阳区期中)向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量 与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( ) Aa 点溶液中含有两种
5、溶质 Bc 点溶液中含有三种溶质 C根据图中数据可以计算出氢氧化钠溶液的浓度为 20% Dd 点溶液中主要存在的离子为 Na+、Cu2+、OH 、SO 42 11 (2019西湖区校级模拟)如图表示化学反应中溶液的颜色变化,其中 X 表示稀盐酸或稀硫酸,则下列 叙述错误的是( ) Aa 可能是紫色石蕊试液 Bb 可能是氧化物 Cc 可能是单质 Dd 可能是单质 12 (2018 秋温州期末)向一定质量 CuCl2和 HCl 的混合溶液中逐滴加入 NaOH 溶液,反应过程中产生沉 淀质量与加入的 NaOH 溶液的质量如图所示。下列说法正确的是( ) AA 点溶质是 CuCl2和 NaCl BB
6、点对应的溶质种类比 C 点多 COA 段溶液的 pH 不变 DBC 段参与反应的物质是 CuCl2和 NaOH 13 (2020 秋温州期中)如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规 律,判断下列选项正确的是( ) A实现转化,可加入氯化钠溶液 B实现转化,可加入稀盐酸溶液 C实现转化,可加入碳酸钙粉末 D实现转化,可加入氢氧化钾溶液 14 (2019 秋鹿城区校级月考)学习了物质的相关性质后,小明列出下列制取 MgCl2的方法,其中不正确 的是( ) AMg+2HClMgCl2+H2 BMgO+2HClMgCl2+H20 CMg(OH)2+2NaClMgCI2+
7、2NaOH DMg+CuCl2MgCl2+Cu 二多选题(共二多选题(共 1 小题)小题) 15 (2020宁波模拟)在一定的条件下,反应物溶液中溶质的质量分数越大,化学反应的速度越快现有 100 克溶质质量分数为 30%的硫酸溶液,与足量的锌粒反应,为了减缓化学反应,而又不影响生成氢气 的总质量,可向该溶液中加入适量的( ) A氢氧化钠溶液 B碳酸钾溶液 C氯化钾溶液 D氯化钡溶液 三填空题(共三填空题(共 8 小题)小题) 16 (2020 秋温州期中)硫酸和盐酸是实验室中两种重要的试剂,用途广泛。 (1)小柯将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字
8、, 立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图甲)放置一盛有某溶液的烧杯,立刻发现 红色的字消失,则烧杯中的溶液可以是 ; (2)探究酸碱反应的过程中是否伴随能量变化,小柯按乙图装置进行实验,其中澄清饱和石灰水的作用 是 ; (3)在稀盐酸的下列用途中,可以用稀硫酸代替的是 (填编号) 。 金属表面除锈 实验室利用它和块状大理石制取 CO2 除去 NaCl 中的少量 NaOH 制造药物氯化锌 17 (2019 秋鹿城区校级月考)如图 1 表示的是向盛有 10mL 稀的甲溶液(其中滴有少量紫色石蕊试剂) 中,加入乙溶液(相同浓度)后,溶液的变化曲线,已知甲、乙分别是盐酸溶液和氢氧化钠
9、溶液中的一 种。请分析曲线回答问题: (1)甲是 溶液:当加入乙溶液的体积为 mL 时,甲、乙溶液恰好完全反应; (2)当溶液的 p2 时,溶液中的溶质有 (指示剂除外) ; (3)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图。请你在图 2 圆圈中填入适当 的化学用语。 18 (2019北仑区校级模拟)将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的 温度,温度随加入稀盐酸的质量变化曲线如图所示: (1)在滴加的过程中,烧杯中溶液的 pH 逐渐 (填“增大” 、 “减小”或“不变” ) 。 (2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是 (填“放热”或“吸热
10、” )反应。 (3)图中 B 点时,溶液中的溶质是 (填化学式) 。 19 (2020 秋温州期中)向一定质量的 CaCl2和 HCl 的混合溶液中逐滴加入 Na2CO3溶液,并振荡。如图 表示反应过程中溶液质量随加入 Na2CO3溶液质量的变化情况,图线 BD 段对应的实验现象是 , 请写出 AB 之间发生反应对应的化学方程式 。 20(2019温州模拟) 癌症是一种恶性肿瘤, 近期科学研究发现用小苏打会 “饿死” 癌细胞。 碳酸氢钠 (NaHCO3) 是小苏打的主要成分,为白色晶体,无臭、味咸,可溶于水,水溶液呈弱碱性。 (1)恶性肿瘤细胞能不间断地进行 ,产生无数与自己相同的恶性肿瘤细胞
11、,在人体内扩散,耗 尽患者营养。 (2)根据上述信息,写出碳酸氢钠的一种物理性质 。 (3)碳酸氢钠水溶液 pH 值 7(选填“” 、 “”或“” ) 21 (2019 春苍南县期末)植物叶片和根尖的结构如图所示 植物根从土壤中吸收水分和无机盐,缺少无机盐会影响植物的生长,若某植物的叶子枯黄,可能是缺乏 元素。 22 (2019温州三模)为比较碳酸氢钠片和铝碳酸镁片对治疗胃酸的效果。某兴趣小组同学进行了如下的 实验。 (1)利用图一装置,取 100 毫升 pH1 的稀盐酸分别和两种药片反应,化学方程式如下: NaHCO3+HClNaCl+CO2+H2O Al2Mg6(OH)16CO34H 2O
12、+18HCl2 +6MgCl2+CO2+21H2O 请写出化学方程式中处物质的化学式。 (2)利用排水法测定产生二氧化碳的体积,则应选择图二中的 装置与图一中的 A 相连。 (3)利用二氧化碳传感器和 pH 传感器分别测出容器内二氧化碳浓度和溶液 pH 变化,并画出下列曲 线。该小组同学认为铝碳酸镁片治疗胃酸的效果更好,请写出两点理由 。 23 (2019 秋余杭区校级期中)有 A、B、C 三种失去标签的无色溶液,它们是硫酸钠、氯化钠和硝酸钠。 分别取少量三种溶液各加入几滴氯化钡溶液,只有 C 出现白色沉淀。另取 A、B 两种溶液各加入几滴硝 酸银溶液,只有 B 产生白色沉淀。由此可得:A 是
13、 ;B 是 ;C 是 。 四实验探究题(共四实验探究题(共 4 小题)小题) 24 (2019 秋温州月考)在学习碱的性质时,为了验证溶液中氢氧化钠能与二氧化碳反应,老师做了下面 两个实验。 实验一:如图甲,将一支充满二氧化碳的试管倒扣在盛有氢氧化钠溶液的烧杯中,观察试管中的液面变 化情况。 实验二:如图乙,向两个装满二氧化碳的同样规格的瓶中分别注入等量的氢氧化钠溶液和蒸馏水,振荡 后放在水平的桌面上,观察 U 形管(装有红墨水)两端液面的变化情况。请问: (1)实验一中观察到试管液面上升,请用化学方程式说明理由: 。 (2)实验二中若观察到 U 形管左端的液面 (填“升高”或“降低” ) ,
14、则证明溶液中氢氧化钠能 与二氧化碳反应。 (3)与实验一相比,同学们认为实验二更合理,因为它能排除 对实验的干扰。 25 (2020温州模拟)科学兴趣小组利用如图所示装置进行实验(图中铁架台等仪器均已略去) 。装置中 的试剂是 BaCl2溶液,在中加入 Zn、稀 H2SO4后,塞紧橡皮塞,立即打开止水夹,一段时间后关闭止 水夹。 (1)该小组同学在整个过程中观察到中出现的现象是 。 (2)实验结束后小组同学把装置和中的溶液倒入废液缸,充分混合后,为探究其溶质有哪些,取出 废液缸中的溶液, 向取出的溶液加入锌粒, 其表面出现大量气泡, 再加入稀硫酸, 溶液中出现白色沉淀。 依据以上现象判断废液缸
15、中的溶质为 。 26 (2019 秋余杭区期中)用下列实验操作可分别完成“实验一:提纯粗盐并测定纯度”和“实验二:配 制 50 克溶质的质量分数为 10%的氯化钠水溶液”两个实验 实验一: (1)请对实验一操作进行排序: (填字母) 实验二: (2) 若图 B 所用的烧杯使用前内壁沾有水, 导致配制溶液中溶质的质量分数会 ; 俯视量取溶剂, 溶质的质量分数会 (填“偏大” 、 “偏小”或“不变” (3)制作过滤器的过程如下图所示,其正确操作顺序为 (填序号) ; (4)对上面两个实验,下列表格中的步骤和说法: 配制溶液正确步骤有 ;粗盐提纯正确说法有 (填序号,可多选) 配制溶液 步骤 1 计
16、算:食盐 5 克 2 称量:先把食盐放在左盘,后在右盘加减砝码 3 量取:用量程 40 毫升量筒量取水 4 溶解:用玻璃棒搅拌加快溶解 粗盐提纯 说法 1 D 中玻璃棒的作用是加速溶解 2 E 中滤液浑浊的原因一定是滤纸破裂 3 D 中所获食盐比理论低的原因可能是加入水不足,食盐没有全溶解 4 A 中称量结晶出的食盐时,先把食盐放在左盘,后在右盘加减砝码 27 (2019 秋乐清市期中)无土栽培是利用营养液栽培作物的一种方法。 (1)下列化学肥料中属于复合肥的是 (填序号) 。 硝酸铵 磷酸二氢铵 硝酸钾 硫酸钾 (2)现有一种无色的营养液可能由 KNO3、Ca(NO3)2、K2CO3、KCl
17、 中的一种或几种物质组成,为探 究其成分,某同学设计并完成了如图所示的实验。 根据以上实验,请你进行有关推断。 由实验 1 可确定原营养液中一定没有的物质是 ; 根据实验 1、实验 2 推测原营养液的组成可能有 种情况; 若测得原营养液中 K+和 Cl 的数目之比为 1:1,则原营养液的组成中的溶质是 。 五计算题(共五计算题(共 1 小题)小题) 28 (2019 春乐清市期中)往 100 克含有盐酸和氯化钙的混合溶液中,加入 21.2%的碳酸钠溶液,所得溶 液的 pH 变化与加入碳酸钠溶液的质量关系如图,试分析计算: (1)ab 段对应的实验现象是 ,化学方程式 (2)反应到 c 点时,溶
18、液中的溶质是 六解答题(共六解答题(共 2 小题)小题) 29 (2019 春鹿城区校级月考)小明将一定质量、一定溶质质量分数的浓碳酸钠溶液和盐酸溶液放在广口 瓶中,按下图甲所示进行实验。弹簧秤示数随时间的变化如图乙所示,请运用所学知识对弹簧秤的读数 随时间变化作出解释。 30 (2019温州模拟)温州产盐历史悠久,常用粗盐提纯的方法(如图所示)得到精盐。 (1)实验室进行“操作”时,需要用到下列器材中的 (可多选) 。 (2)得到精盐中存在少量氯化镁(MgCl2) 。工业上利用氯化镁在通电条件下分解获得镁和氯气(Cl2) , 写出这一反应的化学方程式 。 (3)腌制咸鸭蛋需要合适溶质质量分数
19、的食盐水。现有 5 千克溶质质量分数为 25%的食盐水,若将其稀 释到 20%,需加水多少千克? 2021 年浙江中考科学复习专练(温州专版)年浙江中考科学复习专练(温州专版)专题专题 13 酸碱盐酸碱盐 参考答案与试题解析参考答案与试题解析 一选择题(共一选择题(共 14 小题)小题) 1 【解答】解:A、硝酸铵溶于水吸热,温度降低,不能使装置中的小气球鼓起来,故选项错误。 B、铁和稀硫酸反应生成硫酸亚铁溶液和氢气,能使装置中的小气球鼓起来,且过 4 个小时后,气球无 法恢复原状,故选项正确。 C、固体氢氧化钠溶于水放出大量的热,装置内空气受热膨胀,能使装置中的小气球鼓起来,过 4 个小 时
20、后,温度恢复至常温,气球恢复原状,故选项错误。 D、氯化钠和稀盐酸不反应,不能使装置中的小气球鼓起来,故选项错误。 故选:B。 2 【解答】解:A、柠檬汁的 pH 为 23,小于 7,显酸性,故选项错误。 B、苹果汁的 pH 为 34,小于 7,显酸性,故选项错误。 C、西瓜汁的 pH 为 56,小于 7,显酸性,故选项错误。 D、玉米汁的 pH 为 78,大于 7,显弱碱性,故选项正确。 故选:D。 3 【解答】解:人的胃液中含有盐酸,对于胃酸过多的人应降低其酸性,可食用碱性食物以中和多余的酸。 A、玉米粥的 pH 大于 7 或等于 7 或小于 7,显弱碱性或中性或酸性。故选项正确; B、牛
21、奶的 pH 小于 7,显酸性。故选项错误; C、葡萄的 pH 小于 7,显酸性。故选项错误; D、橘子的 pH 小于 7,显酸性。故选项错误; 故选:A。 4 【解答】解:A、d 点氢氧化钠溶液过量,溶液中滴加酚酞试液,溶液显红色,该选项说法正确; B、bc 段氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,质量关系为: MgCl2+2NaOHMg(OH)2+2NaCl, 80 58 80g10% 5.8g bc 段溶液质量增加:80g5.8g74.2g,该选项说法不正确; C、c 点生成氯化钠质量关系: NaOHNaCl, 40 58.5 160g10% 23.4g 对应溶液的溶质质量分数为:


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2021 浙江温州 中考 科学 复习 专题 13 酸碱 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 浙江温州
- 温州中考中等难度
- 化学专题13
- 2021年浙教版科学中考复习复分解复习含答案
- 2021年浙江温州中考科学复习专题专练17运动和力含答案解析
- 2021年浙江温州中考科学复习专题专练14金属含答案解析
- 2021年浙江温州中考科学复习专题专练23电功率含答案解析
- 2021年浙江温州中考科学复习专题专练6人体健康含答案解析
- 2021年浙江温州中考科学复习专题专练7生物与环境含答案解析
- 中考数学压轴专练专题13
- 2021年浙江温州中考科学复习专题专练16化学实验含答案解析
- 2021年浙江温州中考科学复习专题专练24电和磁 含答案解析
- 2021年浙江温州中考科学复习专题专练12溶液含答案解析
- 2021年浙江温州中考科学复习专题专练13酸碱盐含答案解析
- 2021年浙江温州中考科学复习专题专练18声和光含答案解析
- 2021年浙江温州中考科学复习专题专练21内能含答案解析
- 2021温州
- 2021温州科学
- 温州科学
- 温州中考科学



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-179742.html