 2021届高三化学二轮复习策略
2021届高三化学二轮复习策略
《2021届高三化学二轮复习策略》由会员分享,可在线阅读,更多相关《2021届高三化学二轮复习策略(15页珍藏版)》请在七七文库上搜索。
1、2021 届高届高三三化学第二化学第二复习策略复习策略 一、2012018 8 至至 20202020 年高考年高考全国全国理综理综(化学)试卷分析(化学)试卷分析 试卷总体评价试卷总体评价 高考化学试题全面落实“一核四层四翼”高考评价体系的要求,做到了以化学核心素养为测试宗旨, 精选试题情境呈现真实问题,以化学知识为解决问题的工具,加强了对关键能力的考查。 (一核) 化学试题呈现了稳中求变、稳中求新“的特点,很好地落实了“基础性、应用性、综合性和创新性”的 考查要求,总体难度适中。 (四翼) 试题重视基本概念、必备知识、关键能力的考查,试题将化学知识与信息,以数据列表、实验装置、 结构模型、
2、工艺流程图、电化学装置等图文并茂的方式呈现,集中体现了新课程标准,坚持能力立意,突 出主干知识,重视对考生科学探究、创新意识和实践能力的考查,立足基本知识与方法,突出了学科素养 与能力的考查,让学生从解题中学会解决问题,并能联系生活、生产、技术等方面的应用,形成正确核 心价值观。 (四层) 充分体现了 2017 年版普通高中化学课程标准提出的命题原则 (1)以核心素养为测试宗旨 (2)以真实情境为测试载体 (3)以实际问题为测试任务 (4)以化学知识为解决问题的工具 2018201820202020 年高考(全国卷)化学科年高考(全国卷)化学科双向细目表双向细目表 分类分类 序序 号号 知知
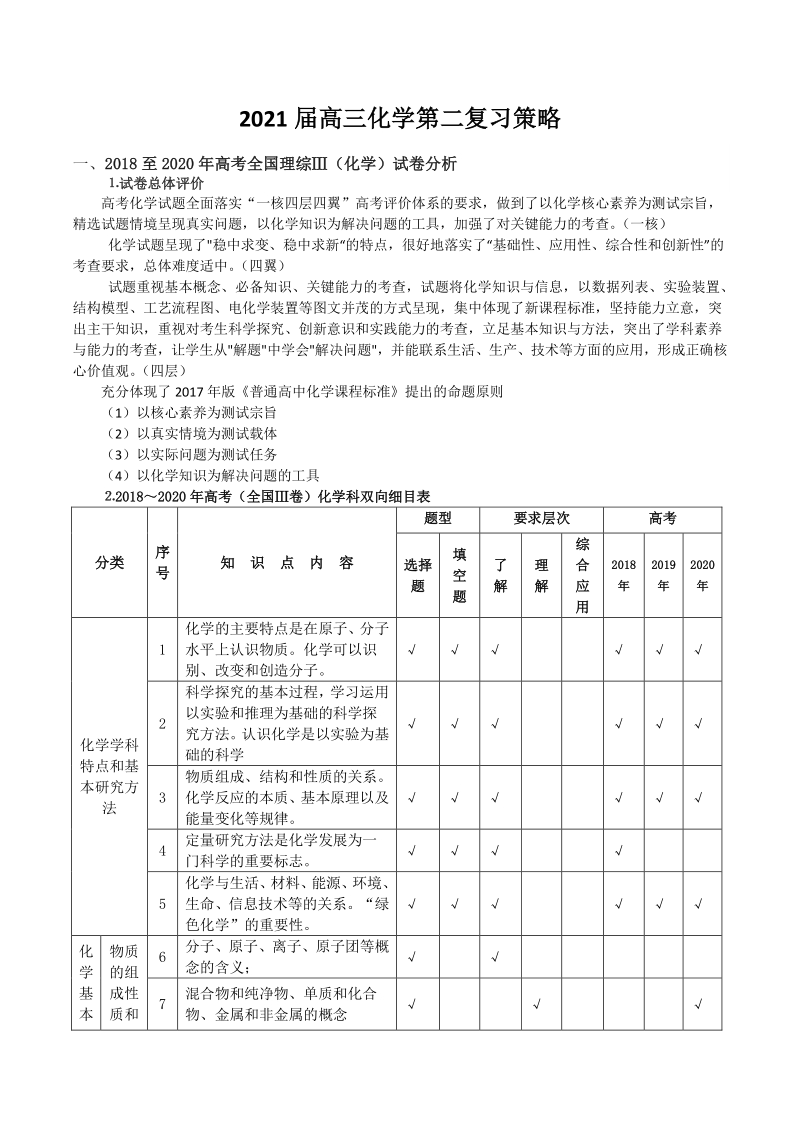
3、识识 点点 内内 容容 题型题型 要求层次要求层次 高考高考 选择选择 题题 填填 空空 题题 了了 解解 理理 解解 综综 合合 应应 用用 20182018 年年 20192019 年年 20202020 年年 化学学科 特点和基 本研究方 法 1 化学的主要特点是在原子、分子 水平上认识物质。化学可以识 别、改变和创造分子。 2 科学探究的基本过程,学习运用 以实验和推理为基础的科学探 究方法。认识化学是以实验为基 础的科学 3 物质组成、结构和性质的关系。 化学反应的本质、基本原理以及 能量变化等规律。 4 定量研究方法是化学发展为一 门科学的重要标志。 5 化学与生活、 材料、 能源
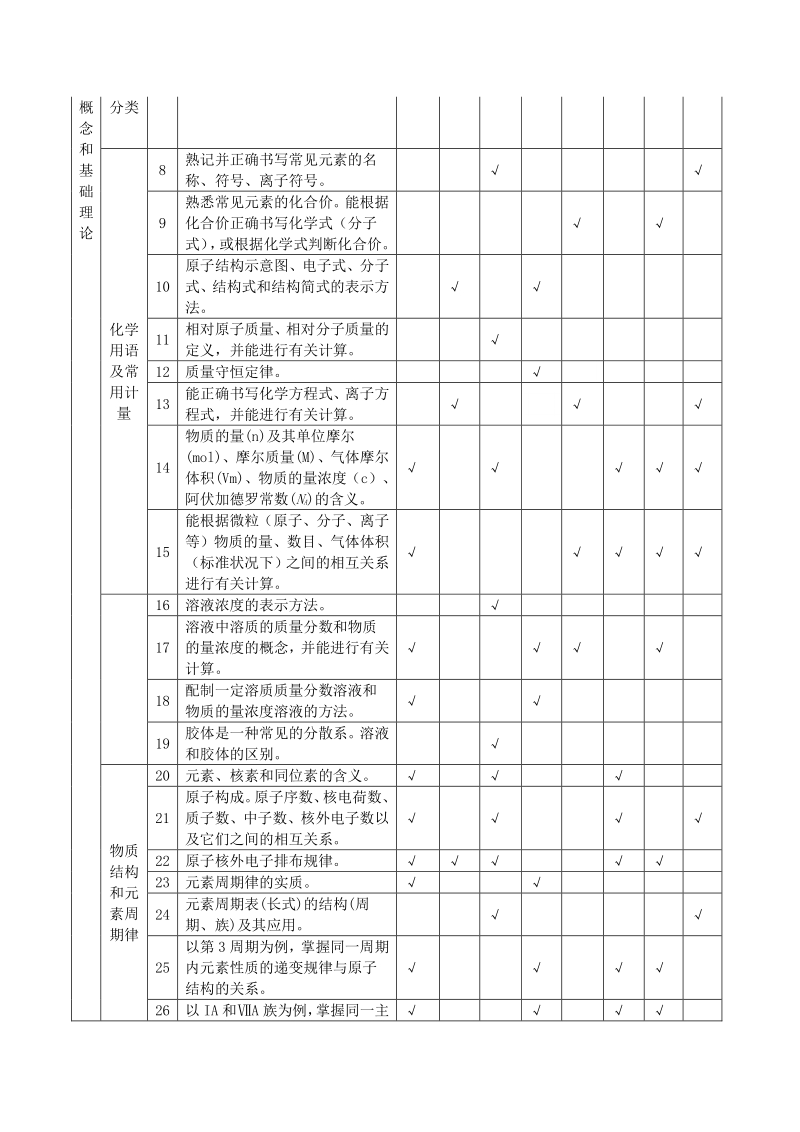
4、、 环境、 生命、信息技术等的关系。“绿 色化学”的重要性。 化 学 基 本 物质 的组 成性 质和 6 分子、原子、离子、原子团等概 念的含义; 7 混合物和纯净物、单质和化合 物、金属和非金属的概念 概 念 和 基 础 理 论 分类 化学 用语 及常 用计 量 8 熟记并正确书写常见元素的名 称、符号、离子符号。 9 熟悉常见元素的化合价。能根据 化合价正确书写化学式(分子 式) , 或根据化学式判断化合价。 10 原子结构示意图、电子式、分子 式、结构式和结构简式的表示方 法。 11 相对原子质量、相对分子质量的 定义,并能进行有关计算。 12 质量守恒定律。 13 能正确书写化学方程式
5、、离子方 程式,并能进行有关计算。 14 物质的量(n)及其单位摩尔 (mol)、摩尔质量(M)、气体摩尔 体积(Vm)、物质的量浓度(c)、 阿伏加德罗常数(NA)的含义。 15 能根据微粒(原子、分子、离子 等)物质的量、数目、气体体积 (标准状况下)之间的相互关系 进行有关计算。 16 溶液浓度的表示方法。 17 溶液中溶质的质量分数和物质 的量浓度的概念,并能进行有关 计算。 18 配制一定溶质质量分数溶液和 物质的量浓度溶液的方法。 19 胶体是一种常见的分散系。溶液 和胶体的区别。 物质 结构 和元 素周 期律 20 元素、核素和同位素的含义。 21 原子构成。 原子序数、 核电荷
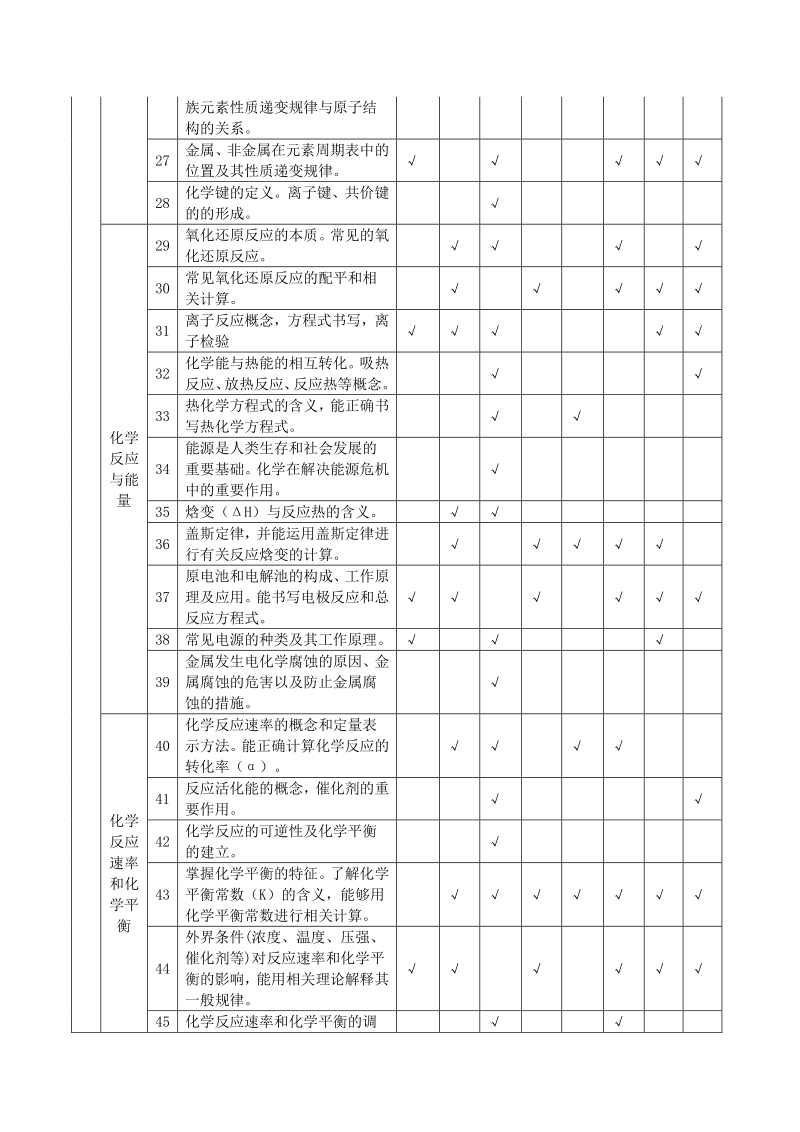
6、数、 质子数、中子数、核外电子数以 及它们之间的相互关系。 22 原子核外电子排布规律。 23 元素周期律的实质。 24 元素周期表(长式)的结构(周 期、族)及其应用。 25 以第 3 周期为例,掌握同一周期 内元素性质的递变规律与原子 结构的关系。 26 以 IA 和A 族为例, 掌握同一主 族元素性质递变规律与原子结 构的关系。 27 金属、非金属在元素周期表中的 位置及其性质递变规律。 28 化学键的定义。离子键、共价键 的的形成。 化学 反应 与能 量 29 氧化还原反应的本质。常见的氧 化还原反应。 30 常见氧化还原反应的配平和相 关计算。 31 离子反应概念,方程式书写,离 子
7、检验 32 化学能与热能的相互转化。吸热 反应、 放热反应、 反应热等概念。 33 热化学方程式的含义,能正确书 写热化学方程式。 34 能源是人类生存和社会发展的 重要基础。化学在解决能源危机 中的重要作用。 35 焓变(H)与反应热的含义。 36 盖斯定律,并能运用盖斯定律进 行有关反应焓变的计算。 37 原电池和电解池的构成、工作原 理及应用。能书写电极反应和总 反应方程式。 38 常见电源的种类及其工作原理。 39 金属发生电化学腐蚀的原因、金 属腐蚀的危害以及防止金属腐 蚀的措施。 化学 反应 速率 和化 学平 衡 40 化学反应速率的概念和定量表 示方法。能正确计算化学反应的 转化
8、率()。 41 反应活化能的概念,催化剂的重 要作用。 42 化学反应的可逆性及化学平衡 的建立。 43 掌握化学平衡的特征。了解化学 平衡常数(K)的含义,能够用 化学平衡常数进行相关计算。 44 外界条件(浓度、温度、压强、 催化剂等)对反应速率和化学平 衡的影响,能用相关理论解释其 一般规律。 45 化学反应速率和化学平衡的调 控在生活、生产和科学研究领域 中的重要作用。 电解 质溶 液 46 电解质的概念、强电解质和弱电 解质的概念。 47 电解质在水溶液中的电离,以及 电解质的导电性。 48 水的电离,离子积常数。 49 了解溶液 pH 的含义及其测定方 法,能进行 pH 的简单计算
9、。 50 理解弱电解质在水溶液中的电 离平衡。能利用电离平衡常数进 行相关计算。 51 盐类水解的原理、影响盐类水解 程度的主要因素、盐类水解的应 用。 52 了解离子反应的概念、离子反应 发生的条件。掌握常见离子的检 验方法。 53 了解难溶电解质的沉淀溶解平 衡。理解溶度积(Ksp)的含义, 能进行相关的计算。 以上各部分知识的综合应用 54 了解常见金属及其重要化合物 的制备方法。掌握其主要性质及 其应用。 55 合金的概念及其重要应用。 常见 非金 属元 素 (如 H、C、 N、O、 Si、 S、 Cl等) 56 常见非金属单质及其重要化合 物的制备方法。 59 常见非金属单质及其重要
10、化合 物的主要性质及其应用。 57 常见非金属元素单质及其重要 化合物对环境质量的影响。 常见有机 物及其应 用 58 有机化合物中碳的成键特征,立 体构型。 59 了解有机化合物的同分异构现 象。能正确书写简单有机化合物 的同分异构体。 60 常见有机反应类型。 61 甲烷、乙烯、苯等有机化合物的 主要性质及其重要应用。 62 乙醇、乙酸的结构和主要性质及 重要应用。 63 糖类、油脂、蛋白质的组成和主 要性质及其重要应用。 64 常见高分子材料的合成反应及 其重要应用。 以上各部分知识的综合应用 化学实验 65 化学实验室常用仪器的主要用 途和使用方法。 66 常见气体的实验室制法(包括所
11、 用试剂、仪器、反应原理和收集 方法)。 67 掌握常见物质进行检验、分离和 提纯的方法。掌握溶液配制方 法。 68 根据化学实验的目的和要求,能 做到:设计实验方案;正确选用 实验装置;掌握控制实验条件的 方法;预测或描述实验现象、分 析或处理实验数据,得出合理结 论;评价或改进实验方案。 物 质 结 构 与 性 质 原子 结构 与元 素性 质 69 了解原子核外电子的运动状态、 能级分布和排布原理。能正确书 写 136 号元素原子核外电 子、价电子的电子排布式和轨道 表达式。 70 电离能的含义,并能用以说明元 素的某些性质。 71 电子在原子轨道之间的跃迁及 其简单应用。 72 了解电负
12、性的概念,并能用以说 明元素的某些性质。 化学 键与 分子 结构 73 离子键的形成,能根据离子化合 物的结构特征解释其物理性质。 74 共价键的形成、极性、类型( 键和键),配位键的含义。 75 能用键能、键长、键角等说明分 子的某些性质 76 杂化轨道理论及简单的杂化轨 道类型(sp、sp2、sp3)。 77 能用价层电子对互斥理论或者 杂化轨道理论推测简单分子或 离子的空间结构。 分子78 范德华力的含义及对物质性质 间作 用力 与物 质的 性质 的影响。 79 氢键的含义,能列举存在氢键的 物质,并能解释氢键对物质性质 的影响。 晶体 结构 与性 质 80 晶体的类型,不同类型晶体中结
13、 构微粒、微粒间作用力的区别。 81 晶格能的概念,晶格能对离子晶 体性质的影响。 82 分子晶体结构与性质的关系。 83 了解原子晶体的特征,能描述金 刚石、二氧化硅等原子晶体的结 构与性质的关系。 84 理解金属键的含义,能用金属键 理论解释金属的一些物理性质。 了解金属晶体常见的堆积方式。 85 了解晶胞的概念,能根据晶胞确 定晶体的组成并进行相关的计 算。 有 机 化 学 基 础 有机 化合 物的 组成 与结 构 86 能根据有机化合物的元素含量、 相对分子质量确定有机化合物 的分子式。 87 了解常见常见有机化合物的结 构。了解有机物分子中的官能 团,能正确表示它们的结构。 88 确
14、定有机化合物结构的化学方 法和某些物理方法(如质谱、红 外光谱、核磁共振氢谱等)。 89 能正确书写有机化合物的同分 异构体(不包括手性异构体)。 90 能根正确命名简单的有机化合 物。 烃及 其衍 生物 的性 质与 应用 91 烷、烯、炔和芳香烃的结构与性 质。 92 卤代烃、醇、酚、醛、羧酸、酯 的结构与性质,以及它们之间的 相互转化。 93 烃类及衍生物的重要应用以及 烃的衍生物合成方法。 94 根据信息能设计有机化合物的 合成路线。 合成 高分 子 95 合成高分子的组成与结构特点。 能依据简单合成高分子的结构 分析其链节和单体。 (注:了解属容易题、理解属中等题、综合应用属难题)(注
15、:了解属容易题、理解属中等题、综合应用属难题) 二、二、高考化学命题特点和趋势高考化学命题特点和趋势 近三年全国化学试题充分,体现了高考命题的主题“一点四面” ,即立德树人、社会主义核心价 值观、依法治国、中华优秀传统文化与创新能力;通过对“一点四面”的考查,发挥高考试题育人导向。 体现了基础知识、基本技能 、基本学科思想方法、基本活动经验的命题重点。 、选择题 (一)(一)近年近年高考选择题的命题特点高考选择题的命题特点 内容基础、题型稳定:考查内容为化学主干知识和基础知识,内容以基本概念和基础理论为主,适 当兼顾有机基础、元素化合物、化学实验和简单计算。 不断调整,回归基础,逐步贴近课标要
16、求。 关注社会、生产生活、科技发展,重视理论联系实际,加强知识应用,淡化死记硬背。 淡化热点,突出能力(分析推理、理解能力、计算能力等) 。 试题力图回避人人皆知的熟题,减少规律化和程式化的试题,体现考试的公平 。 (二)对高考选择题题命题趋势的思考与启示(二)对高考选择题题命题趋势的思考与启示 化学与生活、化学与科技等 STSE 知识能充分体现化学特色 ,试题的命题向深入化的方向发展,充分 体现学以致用,淡化死记硬背。 有关 NA 的试题考查面广,是最符合理综考试特点的题型,这种试题今后会逐渐向创新和深入的方向 发展。 有机化学的主要内容在选修部分,必考命题时容易超出考纲的要求,前几年坚持的
17、 2 道选择题有超 纲要之嫌,在 2014 改为 1 道,且难度下降是情理中的。 原电池试题连续两年未变,主要试题情景都是最新科技成果,容易出题,且能综合考查氧化还原和 计算等内容。今后命题中会重视对原理的理解和应用,注重试题情景新颖陌生度,强化与氧化还原反应的 综合。 物质结构和元素周期律的内容考查较少且逐渐简单,更加接近大纲要求,因为许多考点都在可以在 选修 3 的题目中得到考查。 新增考点沉淀溶解平衡、Ksp 的综合应用等内容将是高考命题将关注新的新热点。但传统题型(离子 方程式判断、离子共存等)也不能遗弃,将会通过新的形式呈现(如 2 卷的元素化合物试题 9,1 卷实验综 合题 13
18、等) 化学实验基本操作试题有逐步增加的趋势。 选择题的常考点主要是考查内容涵盖面宽,命题时知识易于变化,能体现学科内综合和学科方法的中 学化学核心知识。 、非选择题 (一)(一)近年高考选择题的命题特点近年高考选择题的命题特点 体现综合,学科内综合题比例不断扩大。 试题源于教材但高于教材,不考虑知识覆盖面,命题意图主要是为了突出能力考查,特别是对自学 能力、分析解决问题能力的考查,体现了新课程“以学为主”的特点。 重视从图像或图表中获取信息的能力考查(学会利用信息、整合信息分析解决问题)。 突出学科特色,重视试题内容和工业生产和生活实际的联系。(体现学以致用的思想) 体现新课程理念,试题在立意
19、和设问上力求创新,主观题题目情景和问题思维容量比旧课程卷有较 大提高。 (二)对高考选择题题命题趋势的思考与启示(二)对高考选择题题命题趋势的思考与启示 重视理论联系实际,关注化学与社会的协调发展。注重考查对物质世界的观点和价值取向,发挥试 题的教育功能和导向作用。 强调学生化学素养、自主学习能力及学习潜能的考查,问题设置从学生的学习过程入手(避免过于 强调结果) ; 减少虚拟,贴近真实,元素化合物知识更加重视实际应用。 信息呈现形式多样,试题情景设置新信用、灵活新高考提供新材料、营造新情境、分析全新的 内容(不一定是已学过的内容) ; 突出化学科的核心知识、化学学科方法的考查,不追求知识覆盖
20、面。 强化实验考查用“真实验”为素材命题,强调实验能力与探究能力、实验结果处理等问题。 问题的解决方法多样:体现评价的多元允许有开放的多种答案(旧的则是封闭的、唯一) 重视“学习潜能”的主要途径 突出化学核心知识的考查。 以图表、流程、装置等形式呈现新信息,考查学生获取知识能力,以及将新信息和已有信息整合, 重组为新信息块的能力。 关注思维品质的考查。新课标高考试题通过选择合适的素材和要求,考查敏捷性、缜密性、统摄性 和创造性等思维品质。 注重化学学科方法的考查。高考试题要求学生分析处理相关信息(如资料和数据的处理方法) 、) 、根据 给出的有关事实得出规律性结论等。 强化化学实验与探究能力的
21、考查。 三、三、20212021 年高考化学科二轮复习策略年高考化学科二轮复习策略 增强考试说明意识,提高备考的针对性增强考试说明意识,提高备考的针对性 认真学习钻研考试大纲、考试说明,把握要求、明确方向;其次,要把考试大纲与高考 试题、教材、练习相结合,重在发现高考内容的必考点,把握领会高考试题特点及其变化规律,发现今年 处在高考考查方向上的知识点,在吃透考试大纲的基础上,还要把握命题趋向,提高备考的针对性。 增强高考题型意识,提高备考的有效性增强高考题型意识,提高备考的有效性 研究高考考题,各地交流卷、信息卷以及高考真题都是很好的资源,尤其重点研究近几年全国新课标 课改区的高考试题。从中领
22、会出题意图,了解出题难度,把握出题方向。据此准确把握教学的深广度和重 难点,提高备考的有效性。 增强课堂效率意识,提高备考的高效性增强课堂效率意识,提高备考的高效性 (一一) 、基本概念和基础理论的复习、基本概念和基础理论的复习 研究考纲,提高复习效率 将基本概念、基础理论的复习与其他知识的复习密切结合。 元素化合物(两大反应、三种理论、能量变化等) 化学计算(物质的量、化学反应速率与平衡、电离平衡与 pH、沉淀溶解平衡、反应热、电化学等 化学实验(实验原理、溶液浓度、中和滴定、含量测定、成分测定等) 总结规律,构建知识网络 首先要注意对基本概念和基础理论知识梳理,构建知识网络,形成“系统记忆
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2021 届高三 化学 二轮 复习 策略
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-176257.html