 2020-2021学年浙教版科学八年级下册寒假预习 第五讲:模型与符号(含答案)
2020-2021学年浙教版科学八年级下册寒假预习 第五讲:模型与符号(含答案)
《2020-2021学年浙教版科学八年级下册寒假预习 第五讲:模型与符号(含答案)》由会员分享,可在线阅读,更多相关《2020-2021学年浙教版科学八年级下册寒假预习 第五讲:模型与符号(含答案)(13页珍藏版)》请在七七文库上搜索。
1、 HIV-1 原子模型 “人免疫缺陷病毒-1”(HIV-1,最主要的艾滋病病毒)含有一个 包裹着病毒 RNA 基因组的球形衣壳。随着逆转录病毒的成熟,衣壳 通过衣壳蛋白 CA 的自然低聚反应而形成。利用“冷电子显微镜”和“冷 电子断层扫描”方法,结合“全原子、大尺度分子动态模拟”,Gongpu Zhao 等人确定了 HIV-1 衣壳的一个完整原子结构。 所获得的结构模型 显示了衣壳形成、稳定性和病毒感染性所必需的元素。特别令人感兴 趣的是, CA 蛋白羧基端部区域之间在一个新颖的“三倍界面”中的憎水 相互作用,这似乎是成熟衣壳的一个独有特征,以前被认为可能是一 个有吸引力的治疗目标。如图所示为
2、处于病毒包膜内、具有六聚和五 聚组合单元的“人免疫缺陷病毒-1”衣壳的一个原子模型。 一、一、模型与符号模型与符号 1. 模型模型 (1)模型的概念:模型是依照实物的形状和结构按比例制成的物品,是用来显示复杂事物或过程的表 现手段,如图画、图表、计算机图像等。 (2)模型的分类: 物体的复制品; 事物变化的过程; 图片; 数学公式、表达式或特定的词。 (3)模型的作用:建立模型能帮助人们理解他们无法直接观察到的事物,如科学家们经常用模型来代 表非常庞大或极其微小的事物(太阳系中的行星、细胞的细微结构等) 。 2. 符号符号 (1)符号的概念:符号是代表事物的标记。 (2)符号的作用: 能简单明
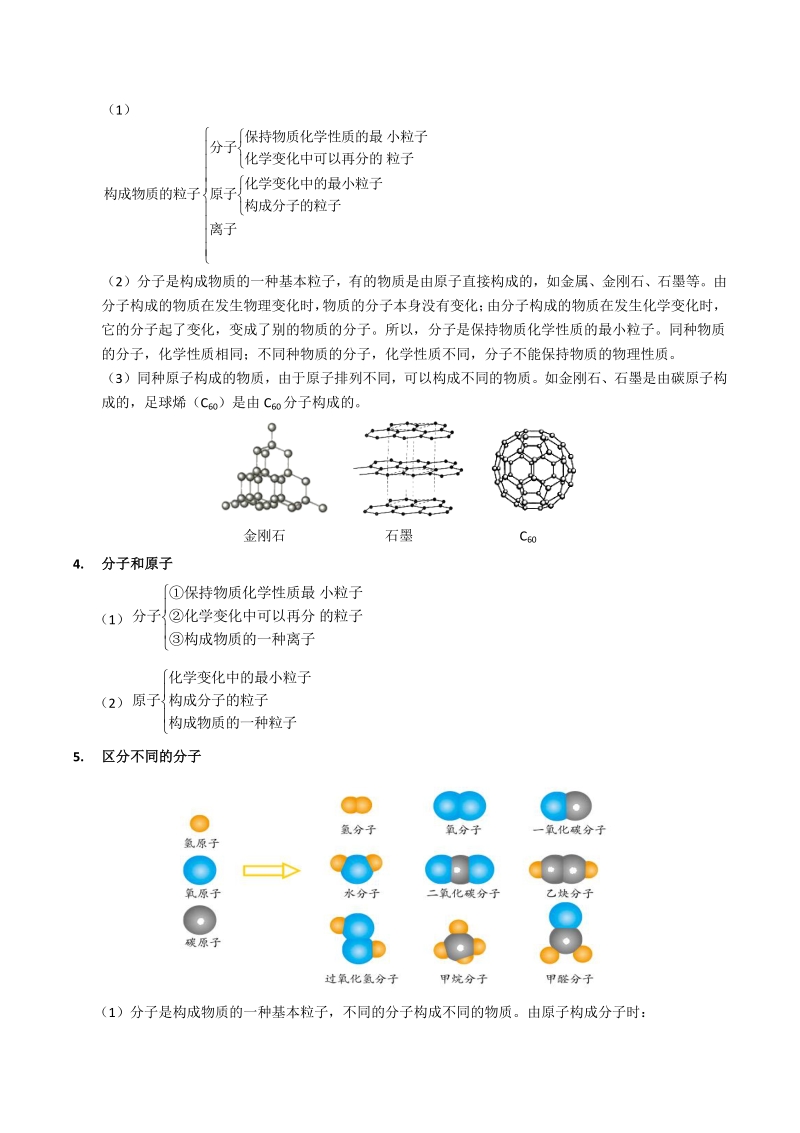
3、了地表示事物。 可以避免由于事物外形不同而引起的混乱。 模型与符号 知识梳理 衔接导入 可以避免由于表达事物的文字语言不同而引起的混乱。 二、二、化学模型的建立化学模型的建立 1. 模型可以是实物的模型,一可以是事件的模型,模型能表达出研究对象的基本的特征。如: 人们用水分子结构模型来了解水分子的构成:两个氢原子成 104.5角附在氧原子上; 比例模型 棍棒模型 分子聚集成物质。 2. 分子的构成分子的构成 (1)分子是由原子构成的。 (2)分子构成的描述:以分子 AmBn为例,1 个 AmBn分子由 m 个 A 原子和 n 个 B 原子构成。 如 1 个 H2分子由 2 个 H 原子构成;1
4、 个 O2分子由 2 个 O 原子构成;1 个 H2O 分子由 2 个 H 原子和 1 个 O 原子构成。 3. 物质的构成物质的构成 特别提醒:特别提醒: 一个模型可以是一幅图、一张表或计算机图像,也可以是一个复杂的对象或过程的示意。 在某种意义上说符号也是一种模型。 (1) 离子 构成分子的粒子 化学变化中的最小粒子 原子 粒子化学变化中可以再分的 小粒子保持物质化学性质的最 分子 构成物质的粒子 (2)分子是构成物质的一种基本粒子,有的物质是由原子直接构成的,如金属、金刚石、石墨等。由 分子构成的物质在发生物理变化时, 物质的分子本身没有变化; 由分子构成的物质在发生化学变化时, 它的分
5、子起了变化,变成了别的物质的分子。所以,分子是保持物质化学性质的最小粒子。同种物质 的分子,化学性质相同;不同种物质的分子,化学性质不同,分子不能保持物质的物理性质。 (3)同种原子构成的物质,由于原子排列不同,可以构成不同的物质。如金刚石、石墨是由碳原子构 成的,足球烯(C60)是由 C60分子构成的。 金刚石 石墨 C60 4. 分子和原子分子和原子 (1) 构成物质的一种离子 的粒子化学变化中可以再分 小粒子保持物质化学性质最 分子 (2) 构成物质的一种粒子 构成分子的粒子 化学变化中的最小粒子 原子 5. 区分不同的分子区分不同的分子 (1)分子是构成物质的一种基本粒子,不同的分子构
6、成不同的物质。由原子构成分子时: 相同的原子种类,不同的原子个数,能够成不同的分子。如 O2分子与 O3分子、CO 分子与 CO2 分子、SO2分子与 SO3分子等。 相同的原子个数,不同的原子种类,也能构成不同的分子。如 H2与 O2、N2,H2O 与 CO2、SO2, CO 与 N2,SO3与 NH3等。 6. 粒子的大小与质量粒子的大小与质量 (1)分子和原子都有一定的质量和体积。 (2)原子的体积很小,原子半径一般在 10-10m 数量级。 (3)分子和原子的质量也非常小。氢分子是最轻的分子,其分子质量的数量级是 10-27kg。 (4)不同种类的分子和原子质量不同,体积也不同。 (5
7、) 分子的特性: 分子在不断运动; 分子间有间隔。 热胀冷缩就是分子间间隔发生改变的结果。 7. 化学反应实质、模型的建立化学反应实质、模型的建立 (1)当水分子分解时,生成氢原子和氧原子,每两个氢原子又结合成一个氢分子,每两个氧原子结合成 一个氧分子。 (2)结论: 分子是由原子构成的; 物质在发生化学变化时,分子分解成原子,原子重新组合 形成新的分子。在化学变化中,分子是可以再分的,原子是不能再分的,原子是化学变化中的最 小粒子。 三、原子的构成三、原子的构成 1. kg101176. 9 kg106748. 1 kg106726. 11 31- 27- 27- 质量为核外电子:带负电荷,
8、 为中子:不带电荷,质量 个单位正电荷,质量为质子:带 原子核 )原子( X A Z 2. 原子是“空心球体”,原子里有“很大”的空间,电子在绕核做高速运动。 3. 原子核所带的电量和核外电子的电量相等,但电性相反,因此整个原子不显电性。对原子而言,核电 荷数=质子数=核外电子数。 4. 一般地,原子核内质子数小于或等于中子数。 5. 原子的质量主要集中在原子核上。 特别提醒:特别提醒: 物质由什么粒子直接构成,其化学性质就由该种粒子保持。 构成分子的原子可以是同种原子(如 H2、O2、N2等) ,也可以是不同种原子(如 CO、H2O 等) 。 特别提醒:特别提醒: 组成某个分子的原子,肯定比
9、分子更小,如氢分子由 2 个氢原子构成,氢原子比氢分子小。但并不 能说原子一定比分子小,某些原子比某些分子大,如铁原子比氢分子大。 6. 质子和中子都是由更微小的基本粒子夸克构成的。 7. 原子符号(X A Z )中 X原子种类,Z质子数,A质子数与中子数之和。 四、元素与同位素四、元素与同位素 1. 元素概念:元素概念:具有相同核电荷数(即质子数)的一类原子总称为元素。 2. 同位素概念:同位素概念:原子中核内质子数相同、中子数不同的同类原子统称为同位素。 3. 元素、同位素的比较元素、同位素的比较 元素 同位素 概念 具有相同核电荷数(即质子数)的一类原子称为 元素 具有相同质子数和不同中
10、子数的同一元素的不同 原子互称同位素 研究 范围 核电荷数(即质子数)相同的一类原子 同一种元素中,中子数不相同的原子 特性 具有相同质子数,其带的电荷数可以不同,具有 的化合价可以不同,所以具有的性质也不同 原子的质子数相同而中子数不同,所以质量数不 同,但同价态的同位素化学性质几乎完全相同 实例 如: Fe、 Fe2+、 Fe3+为铁元素, 5432103 NNNNNNN、 为氮元素,其物理性质和化学性质都不同 如:HHH 3 1 2 1 1 1 、氢元素三种同位素化学性质 几乎相同 五、五、离子离子 1. 概念:概念:离子是带电荷的原子或原子团。 原子团是“原子的集团”,由几个原子组成,
11、在许多化学反应里作为一个整体参加反应。 2. 分类:分类: 阳离子:带正电荷;质子数大于电子数。 阴离子:带负电荷;质子数小于电子数。 六、六、元素与原子的比较元素与原子的比较 元素 原子 概念 具有相同核电荷数(质子数)的一类原子的总称。一种元 素可含几种原子,如氢元素包含HHH 3 1 2 1 1 1 、三种原子 化学变化中的最小粒子 种类 确定 由核内质子数确定 由质子数和中子数确定 区别 宏观概念:只讲种类,不讲个数,没有数量多少的含义 微观概念:既讲种类,又讲个数,有数 量多少的含义 使用 范围 用于描述物质的宏观组成,如水由氢、氧两种元素组成 用于描述物质的微观构成,如 1 个水分
12、 子由 2 个氢原子和 1 个氧原子构成 联系 元素与原子是总体与个体的关系,原子是元素的个体,是构成和体现元素性质的最小粒子。在化学 特别提醒:特别提醒: 元素概念中的“一类原子”包括: 质子数相同、中子数不同的同位素原子,如、。 质子数相同、化合价不同的元素,如 0、+1、+3、+5、+7、-1 价的氯元素。 质子数相同的单核粒子,如 Cl-与 Cl 原子都属于氯元素。 元素只论种类,不讲个数。 元素是同位素原子的总称,同位素原子是一种元素的不同种原子,即原子的“孪生兄弟”。同位素原子有“三相 同三不同”,三相同是:质子数相同、电子数相同、化学性质相同;三不同是:中子数不同、原子质量不同、
13、 物理性质不同。 反应中,元素种类、原子种类和原子个数均不发生变化 七、七、原子和离子的比较原子和离子的比较 粒子种类 原子 离子 阳离子 阴离子 区别 粒子结构 核内质子数=核外电子数 核内质子数核外电子数 核内质子数核外电子数 粒子电性 中性 正电 负电 联系 阴离子原子阳离子 得电子 失电子 得电子 失电子 八、八、应用应用“四数一量四数一量”分析原子结构分析原子结构 1. “四数一量” 原子:核电荷数=质子数=核外电子数;近似相对原子质量=质子数+中子数。 核电荷数”指原子核所带的电荷数,即质子所带电荷数之和。 并非所有原子核中都含有中子,如H 1 1 没有中子。一般地:质子数中子数。


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020-2021学年浙教版科学八年级下册寒假预习 第五讲:模型与符号含答案 2020 2021 学年 浙教版 科学 年级 下册 寒假 预习 第五 模型 符号 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-169077.html