 2021届九年级最新初中化学化合价、化学式、化学方程式总结
2021届九年级最新初中化学化合价、化学式、化学方程式总结
《2021届九年级最新初中化学化合价、化学式、化学方程式总结》由会员分享,可在线阅读,更多相关《2021届九年级最新初中化学化合价、化学式、化学方程式总结(9页珍藏版)》请在七七文库上搜索。
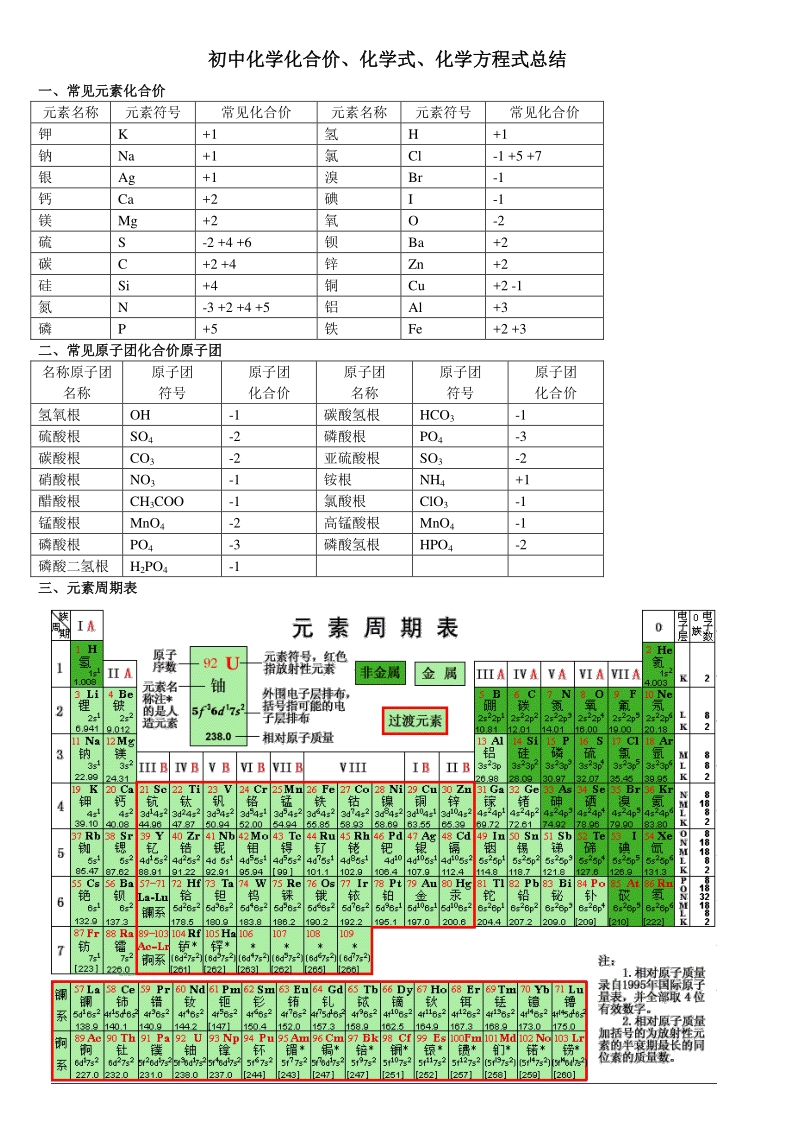
1、 初中化学化合价、化学式、化学方程式总结初中化学化合价、化学式、化学方程式总结 一、常见元素化合价一、常见元素化合价 元素名称 元素符号 常见化合价 元素名称 元素符号 常见化合价 钾 K +1 氢 H +1 钠 Na +1 氯 Cl -1 +5 +7 银 Ag +1 溴 Br -1 钙 Ca +2 碘 I -1 镁 Mg +2 氧 O -2 硫 S -2 +4 +6 钡 Ba +2 碳 C +2 +4 锌 Zn +2 硅 Si +4 铜 Cu +2 -1 氮 N -3 +2 +4 +5 铝 Al +3 磷 P +5 铁 Fe +2 +3 二、常见原子团化合价原子团二、常见原子团化合价原子团
2、名称原子团 名称 原子团 符号 原子团 化合价 原子团 名称 原子团 符号 原子团 化合价 氢氧根 OH -1 碳酸氢根 HCO3 -1 硫酸根 SO4 -2 磷酸根 PO4 -3 碳酸根 CO3 -2 亚硫酸根 SO3 -2 硝酸根 NO3 -1 铵根 NH4 +1 醋酸根 CH3COO -1 氯酸根 ClO3 -1 锰酸根 MnO4 -2 高锰酸根 MnO4 -1 磷酸根 PO4 -3 磷酸氢根 HPO4 -2 磷酸二氢根 H2PO4 -1 三、元素周期表三、元素周期表 四、化学式四、化学式 1、非金属单质: 氢气 H2 金刚石/石墨 C 氮气 N2 氧气 O2 磷 P 硫 S 氯气 Cl
3、2 2、金属单质: 钠 Na 镁 Mg 铝 Al 钾 K 钙 Ca 铁 Fe 锌 Zn 铜 Cu 钡 Ba 钨 W 汞 Hg 3、非金属氧化物: 水 H2O 一氧化碳 CO 二氧化碳 CO2 五氧化二磷 P2O5 二氧化氮 NO2 二氧化硅 SiO2 二氧化硫 SO2 三氧化硫 SO3 一氧化氮 NO 4、金属氧化物: 氧化镁 MgO 氧化铜 CuO 氧化钡 BaO 氧化亚铜 Cu2O 氧化钠 Na2O 氧化亚铁 FeO 三氧化二铁(铁红)Fe2O3 四氧化三铁 Fe3O4 三氧化二铝 Al2O3 三氧化钨 WO3 氧化银 Ag2O 氧化铅 PbO 二氧化锰 MnO2 5、常见的酸: 硫酸 H
4、2SO4 盐酸 HCl 硝酸 HNO3 磷酸 H3PO4 硫化氢 H2S 溴化氢 HBr 碳酸 H2CO3 醋酸 CH3COOH 6、常见的碱: 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2 氢氧化钡 Ba(OH)2 氢氧化镁 Mg(OH)2 氢氧化铜 Cu(OH) 2 氢氧化钾 KOH 氢氧化铝 Al(OH) 3 氢氧化铁 Fe(OH) 3 氢氧化亚铁 Fe(OH) 2 7、常见的盐氯化物/盐酸盐: 氯化钾 KCl 氯化钠(食盐)NaCl 氯化镁 MgCl2 氯化钙 CaCl2 氯化铜 CuCl2 氯化锌 ZnCl2 氯化钡 BaCl2 氯化铝 AlCl3 氯化亚铁 FeCl2 氯化铁 Fe
5、Cl3 氯化银 AgCl 8、常见的盐硫酸盐: 硫酸铜CuSO4 硫酸钡BaSO4 硫酸钙CaSO4 硫酸钾K2SO4 硫酸镁MgSO4 硫酸亚铁FeSO4 硫酸铁 Fe2 (SO4) 3 硫酸铝 Al2 (SO4) 3 硫酸氢钠 NaHSO4 硫酸氢钾 KHSO4 亚硫酸钠 NaSO3 9、常见的盐硝酸盐: 硝酸钠NaNO3 硝酸钾KNO3 硝酸银AgNO3 硝酸镁MgNO3 硝酸铜Cu(NO3) 2 硝酸钙Ca(NO3) 2 亚硝酸钠NaNO3 10、常见的盐碳酸盐/碳酸氢盐: 碳酸钠 Na2CO3 碳酸氢钠 NaHCO3 碳酸钙 CaCO3 碳酸镁 MgCO3 碳酸钾 K2CO3 碳酸氢
6、钾 KHCO3 11、常见的盐酸式盐/碱式盐: 碳酸氢钠NaHCO3 碳酸氢钾KHCO3 碳酸氢铵NH4HCO3 磷酸二氢钾KH2PO4 碱式碳酸铜Cu2 (OH) 2CO3 12、常见有机物: 甲烷 CH4 乙炔 C2H2 甲醇 CH3OH 乙醇 C2H5OH 乙酸 CH3COOH 13、常见结晶水合物: 石膏 CaSO42H2O 明矾 KAl(SO4) 212H2O 绿矾 FeSO47H2O 蓝矾 CuSO45H2O 碳酸钠晶体 Na2CO3 10H2O 14、常见化肥: 尿素 CO(NH2) 2 硝酸铵 NH4NO3 硫酸铵(NH4) 2SO4 碳酸氢铵 NH4HCO3 磷酸二氢钾 KH
7、2PO4 15、常见沉淀及其颜色: 碳酸钙 CaCO3(白色) 氯化银 AgCl(白色) 碳酸钡 BaCO3(白色) 硫酸钡 BaSO4(白色) 氢氧化亚铁 Fe(OH) 2(白色) 硫化锌 ZnS (白色) 硫化锑 Sb2S3 (橙红色) 氢氧化铁 Fe(OH) 3 (红褐色) 氢氧化铜 Cu(OH)2 (天蓝色) 硫化铁 FeS (黑色) 氢氧化铝 Al(OH) 3 (白色) 二氧化锰 MnO2 (黑色) 氢氧化银 AgOH (白色) 磷酸银 Ag3PO4(白色) 硫酸钙 CaSO4(白色) 碳酸银 Ag2CO3(淡黄色) 二硫化铁 FeS2 (黄色) 氢氧化镁 Mg(OH) 2 (白色)
8、 硫酸铅 PbSO4 (白色) 硫化铜 CuS 碱式碳酸铜 Cu(OH) 2CO3 (暗绿色)溴化银 AgBr(淡黄色) 碘化银 AgI(黄色) (黑色)硫化铅 PbS(棕黑 色) 16、常见俗名与化学式、常见俗名与化学式: 硫酸盐类:硫酸盐类: 1.皓矾: ZnSO47H2O 2.钡餐,重晶石: BaSO4 3.绿矾,皂矾,青矾: FeSO47H2O 4.芒硝,朴硝,皮硝: Na2SO410H2O 5.明矾: KAl(SO4) 212H2O 6.生石膏:CaSO42H2O 熟石膏:2CaSO4H2O 7.胆矾、蓝矾:CuSO45H2O 8.莫尔盐: (NH4)2SO4、FeSO46H2O 矿
9、石类:矿石类: 1.莹石:CaF2 2.光卤石: KCl.MgCl26H2O 3.黄铜矿: CuFeS2 4.矾土:Al2O3H2O、Al2O33H2O 和少量 Fe2O3 、SiO2 5.磁铁矿石: Fe3O4 6.赤铁矿石:Fe2O3 7.褐铁矿石: 2Fe2O33H2O 8.菱铁矿石:Fe2CO3 9.镁铁矿石:Mg2SiO4 10.苏口铁:碳以片状石墨形式存在 11.白口铁:碳以 FeC3形式存在 12.高岭石: Al2 (Si2O5)(OH) 4 或(Al2O3、2SiO22H2O) 13.正长石: KAlSi3O8 14.石英:SiO2 15.硼砂: Na2B4O710H2O 16
10、.脉石:SiO2 17.刚玉(蓝宝石.红宝石): 天然产的无色氧化铝晶体 18.黄铁矿(愚人金) :FeS2 19.炉甘石:ZnCO3 20.智利硝石:NaNO3 21.滑石:3MgO、4SiO2H2O 22.大理石(方解石、石灰石) :CaCO3 23.孔雀石:CuCO3、Cu(OH)2 24.白云石:MgCO3、CaCO3 25.冰晶石:Na3AlF6 26.高岭土:Al2O3、2SiO22H2O 27.锡石:SnO2 28.辉铜矿:Cu2S 气体类:气体类: 1.高炉煤气:CO、CO2等混合气体 2.水煤气:CO、H2 3.天然气(沼气) :CH4 4.液化石油气:C3H8,C4H10
11、为主 5.焦炉气:CH4、CO、H2、C2H4为主 6.裂解气:C2H4为主 7.爆鸣气:H2、O2 8.笑气:N2O 9.裂化气:C1C4的烷烃、烯烃 10.电石气:C2H2(通常含 H2S、PH3等) 有机类:有机类: 1.福尔马林(蚁醛) : HCHO 2.蚁酸:HCOOH 3.尿素: (NH4CNO)或 CO(NH2) 2 4.氯仿: CCl4 5.木精(工业酒精) :CH3OH 6.甘油: CH2OH-CHOH- CH2OH 7.硬脂酸:C17H35COOH 8.软脂酸: C15H31COOH 9.油酸: C17H33OH 10.肥皂:C17H35COONa 11.银氨溶液:Ag(N
12、H3) 2+ 12.乳酸:CH3-CHOH-COOH 13.葡萄糖:C6H12O6 14.蔗糖:C12H22O11 15.核糖:CH2OH-(CHOH) 3CHO 16.脱氧核糖:CH2OH-(CHOH) 2CH2-CH3 17.淀粉: (C6H10O5)n 18.火棉,胶棉:主要成份都是(C6H7O2)-(ONO2) 2n 只是前者含 N 量高 19.尿素: CO(NH2) NH4CNO 为氰酸铵(互为同分异构体) 20.氯仿: CHCl3 21.油酸: C17H33COOH 22.银氨溶液:Ag(NH3) 2OH 23.脱氧核糖:CH2OH-(CHOH) 2CH2-CHO 其他类:其他类:
13、 1.白垩: CaCO3 2.石灰乳、消石灰、熟石灰:Ca(OH) 2 3.熟石膏: 2CaSO4H2O 4.足球烯: C60 5.铜绿:Cu2 (OH) 2CO3 6.纯碱(碱面) : Na2CO3 7.王水: HCl、HNO3 (3:1) 8.水玻璃(泡火碱) :Na2SiO3 9.小苏打:NaHCO3 10.苏打:Na2CO3 11.大苏打(海波) :Na2S2O3 12.盐卤:MgC126H2O 13.雌黄:As2S3 14.雄黄:As4S4 15.朱砂:HgS 16.石棉:CaO、3MgO、4SiO2 17.砒霜:As2O3 18.泻盐:MgSO47H2O 19.波尔多液:CuSO4
14、、Ca(OH) 2 20.钛白粉:TiO2 21. 纯碱、苏打、口碱:Na2CO3 22. 双氧水:H2O2 23.生石灰:CaO 24. 火碱、烧碱、苛性钠:NaOH 17、常见固体、液体颜色:、常见固体、液体颜色: 固体的颜色固体的颜色 1、红色固体:铜,氧化铁 2、绿色固体:碱式碳酸铜 3、蓝色固体:氢氧化铜,硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺 6、无色固体:冰,干冰,金刚石 7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁, (碳黑,活性炭) 9、红褐色固体:氢氧化铁 10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2021 九年级 最新 初中化学 化合价 化学式 化学方程式 总结
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-167342.html