 2019-2020学年安徽省合肥五十中九年级上第三次质检化学试卷(含答案解析)
2019-2020学年安徽省合肥五十中九年级上第三次质检化学试卷(含答案解析)
《2019-2020学年安徽省合肥五十中九年级上第三次质检化学试卷(含答案解析)》由会员分享,可在线阅读,更多相关《2019-2020学年安徽省合肥五十中九年级上第三次质检化学试卷(含答案解析)(23页珍藏版)》请在七七文库上搜索。
1、2019-2020学年合肥五十中九年级(上)第三次质检化学试卷一、本大题包括10小题,每小题2分,共20分.每小题4个选项中只有1个符合题意.1(2分)在下列生产、生活过程所涉及的变化中,主要属于化学变化的是()A撒干冰降雨B太阳能路灯C垃圾用来发电D蒸馏淡化海水2(2分)小洋同学的午餐已有米饭、糖醋排骨、麻辣豆腐三种食物,从营养均衡的角度考虑,小洋应该增加的食物是()A红烧鱼B炒青菜C蒸馒头D煮鸡蛋3(2分)化学科学的发展促进了人类社会的进步,提高了人们的生活品质。请你用学过的化学知识分析下列问题,其中正确的是()A合金、塑料、合成纤维等都属于有机合成高分子材料B利用化学反应中的能量转化,人
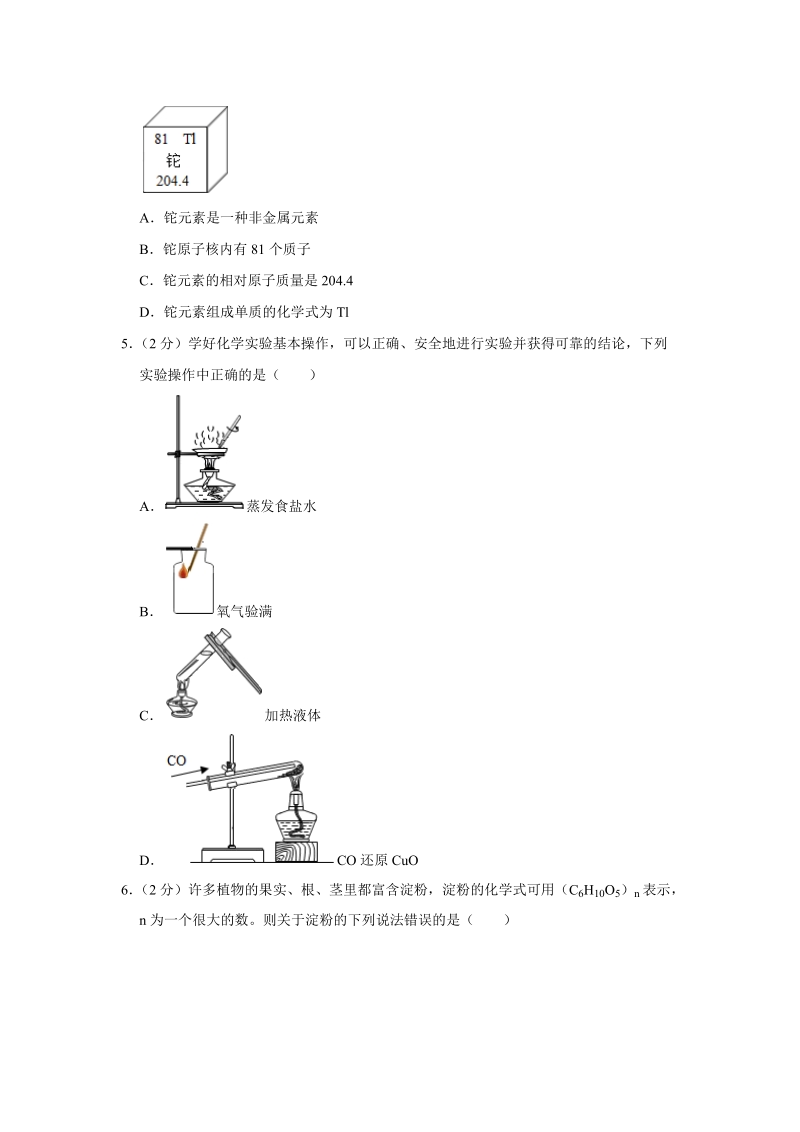
2、类可以开发新的能源C常用钢丝球擦洗铝锅,可以使铝锅光亮洁净、更加耐用D化石燃料的使用导致空气中的 CO2 增多,是形成酸雨的主要原因4(2分)某大学发生的“铊中毒案”使许多人知道了铊(音 t)元素。铊元素可以造成以神经系统损害为主的全身性疾病。如图是元素周期表中铊元素的相关信息,据此分析下列说法中错误的是()A铊元素是一种非金属元素B铊原子核内有81个质子C铊元素的相对原子质量是204.4D铊元素组成单质的化学式为Tl5(2分)学好化学实验基本操作,可以正确、安全地进行实验并获得可靠的结论,下列实验操作中正确的是()A蒸发食盐水B氧气验满C加热液体DCO还原CuO6(2分)许多植物的果实、根、
3、茎里都富含淀粉,淀粉的化学式可用(C6H10O5)n表示,n为一个很大的数。则关于淀粉的下列说法错误的是()A淀粉属于人体必需的六大类营养素之一B淀粉充分燃烧后只生成二氧化碳和水C淀粉中碳、氢、氧原子个数比为6:10:5D淀粉的相对分子质量是1627(2分)浙江大学课题组近日制备出了一种只含碳元素的超轻气凝胶,如图是超 轻气凝胶放在桃花的花蕊上。气凝胶由碳原子构成,内部有无数个孔隙,充斥空气,故而得名。下列关于超轻气凝胶说法不正确的是()A气凝胶常温下化学性质稳定B气凝胶具有很强的吸附作用C气凝胶可以用来净化被污染的水源D气凝胶化学性质和金刚石差异很大8(2分)乙二醇是重要化工原料。我省有丰富
4、的煤炭资源,用煤制取乙二醇因具有低成本、低能耗、低 排放等特点因而具有非常广阔的前景,乙二醇制取流程和造气反应的微观示意图如图所示。则下列 说法错误的是()A合成气有还原性,可用来还原金属氧化物B造气过程发生反应的类型属于复分解反应C用煤制取乙二醇符合“节能减排”的宗旨D在造气过程中原子的种类和数目都没改变9(2分)下列除杂质的方法错误的是()序号括号里是要除去的杂质除杂质的方法A铜粉(木炭粉)在氧气中充分灼烧混合物B二氧化锰(氯化钾)溶解、过滤、洗涤、干燥C氯化钠固体(碳酸钠)加入稍过量的盐酸、蒸发D一氧化碳气体(二氧化碳)通过足量氢氧化钠和浓硫酸AABBCCDD10(2分)将一片未打磨的铝
5、片和足量的稀盐酸放入密闭容器中,用传感器探测反应过程中压强和温度的变化,结果如图所示。下列说法错误的是()A铝和稀盐酸反应生成气体并放热Bt1 时间前是盐酸和氧化铝发生反应Ct2 时间后压强减小是因为反应变慢了Dt3 时间时溶液中含氯化铝和氯化氢二、本大题包括5小题,共34分.11(6分)砝码是化学实验室中的常用实验器材,如图所示是一盒砝码的实物图。请你回答下列问 题:(1)不锈钢属于 (填“单质”、“化合物”或“混合物”);图中属于合成材料的是 。(2)砝码表面镀铬不仅美观,还可以防锈,铁锈主要成分的化学式是 。工业上常用 除去钢铁表面的铁锈。(3)铬与浓硫酸发生反应的化学方程式为:2Cr+
6、6H2SO4Cr2(SO4)3+3SO2+6H2O,产生的SO2可用 性(填“酸”或“碱”)溶液来吸收,以减少对环境的污染。12(7分)为研究酸的性质,化学研究小组的同学进行了如下探究。小涵同学将颗粒大小相同的纯锌粒和粗锌粒中分别加入相同浓度的稀硫酸中。写出锌与硫酸反应的化学方程式 。(1)小涵通过观察发现纯锌粒与硫酸的反应明显比粗锌粒慢。通过查阅资料得知粗锌中含有一些不活泼金属,她猜想可能是粗锌中不活泼金属促进了锌与硫酸的反应。 为了验证小涵的猜想,你认为应该在盛有纯锌粒和稀硫酸的试管中,加入下列那种物质? ,选择该物质的理由是 。AHCl BCuCl2 CNaCl DCaCl2(2)实验中
7、小涵发现加入上述四种物质,纯锌与稀硫酸的反应都有不同程度的加快,请你分析可能的原因是什么? 。(3)小川同学想通过用一定质量粗锌与足量的硫酸反应,测量生成氢气的体积来计算粗锌的纯度,于是设计了如图所示的实验装置。(4)在虚线框中应接入图中的 ,广口瓶上方残留的空气 (填“会”或“不会”)对 氢气体积的测量造成影响。13(7分)化学实验室要从含少量铜粉的银、锰混合金属粉末中分离出贵金属,并获得一种盐晶体,将这三种金属随意编号为:A、B、C,并设计了如图 1 所示流程:(1)A、B、C 三种金属的活动性由强到弱顺序为 (用元素符号表示)。活泼金属将不活泼金属从溶液中置换出来,实质上是电子在原子和离
8、子间的转移,图 2 中用“”表示电子在铁原子和铜离子间移动,则电子的移动方向是 (填序号,“从铁原子到铜离 子”或“从铜离子到铁原子”)。(2)写出上述实验中产生的无色气体的一种用途 。进行蒸发 时,观察到蒸发皿内 ,停止对蒸发皿进行加热。(3)金属 B 与硝酸银反应的化学方程式为 。除了用活泼金属外,判断滤液中是否有硝酸银剩余的方法是 。14(7分)珍珠粉是由珍珠加工制成的白色粉末,主要成分是碳酸钙,是重要的化妆品原料。市场 上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼无法辨别它们。【提出问题】假珍珠粉的主要成分是什么?真假珍珠粉的差别在哪里?【作出猜想】含有碳酸钙; 含有蛋白质; 含有碳酸
9、钙和蛋白质【实 验 一】为了确认珍珠粉的组成,同学们进行了下列实验:操作方法结论与化学反应方程式通过 a、b 实验及其他手段,证明了二者都 含有碳酸钙。b 中化学反应方程式: 判断真、假珍珠粉中是否含蛋白质的方法是: 真珍珠粉中含有蛋白质,假珍珠粉中不含蛋白质。【拓展实验】将 a 中完全反应后的混合物过滤,测得滤液的 pH2,是什么物质使滤液的 pH2?小羽和小昊分析后认为只有两种可能性并作了猜想:猜想:反应后生成的碳酸猜想:反应后剩余的盐酸【实验二】小羽和小昊用下列实验对猜想进行验证。实验操作实验现象实验结论向蒸馏水中通入 至饱和,测 pHpH 约为 5.6猜想错误向滤液中滴入石蕊试液,然后
10、加热至沸腾 猜想正确写出猜想发生的化学反应方程式 。15(7分)碳酸钠广泛用于造纸、纺织、洗涤剂等工业,是一种重要的化工原料。工业制碱法的原 理是:NaCl+NH3+CO2+H2ONaHCO3+NH4Cl,然后加热分解 NaHCO3 固体得到 Na2CO3 兴趣小组采用下列装置模拟工业制碱法制备碳酸氢钠,进而制得碳酸钠。【查阅资料】氨气易溶于水,通常状况下 1 体积水约溶解700体积的氨气;二氧化碳能溶于水,通常状况下1体积水约溶解1体积的二氧化碳。【实验过程】(1)关闭K1,打开 K2通入NH3 并调节气流速率,然后打开 K1通入CO2。(2)当三颈烧瓶内出现较多固体时,先后停止通入两种气体
11、。(3)将三颈烧瓶内反应后的混合物过滤、洗涤,并将所得固体加热充分加热。【问题讨论】(1)停止通气后三颈烧瓶内的溶液是否是NaHCO3的饱和溶液? 。洗气瓶中饱和NaHCO3溶液的作用是 (用化学方程式表示)。(2)实验中长颈漏斗的作用是 。有同学认为应在长颈漏斗内放 置蘸有酸液的棉花,理由是 。(3)依据“查阅资料”所得信息,实验结束时应先停止通CO2还是NH3? 。已知氯化铵、氯化钠和碳酸氢钠的溶解度如图所示,从反应后的滤液里得到氯化铵固体可采用的方法 是 。(4)实验过程中先通入NH3,能充分吸收CO2的原因是 。实验中用生石灰能更好地产生氨气,理由是 、 。(5)加热分解 NaHCO3
12、 固体得到Na2CO3,判断得到的Na2CO3固体中是否有NaHCO3剩余的方法是 。三、本大题共6分16(6分)实验室常用过氧化氢溶液在二氧化锰的催化下制氧气。(1)过氧化氢中氧元素的化合价为 。(2)生成0.8g氧气需要消耗多少溶质质量分数为5%的过氧化氢溶液?2019-2020学年安徽省合肥五十中九年级(上)第三次质检化学试卷参考答案与试题解析一、本大题包括10小题,每小题2分,共20分.每小题4个选项中只有1个符合题意.1(2分)在下列生产、生活过程所涉及的变化中,主要属于化学变化的是()A撒干冰降雨B太阳能路灯C垃圾用来发电D蒸馏淡化海水【分析】有新物质生成的变化属于化学变化,没有新
13、物质生成的变化属于物理变化,判断化学变化的唯一标准是有新物质生成。【解答】解:A、干冰升华过程中吸热,没有生成新物质,是物理变化;B、太阳能转化成电能过程中,没有生成新物质,是物理变化;C、垃圾用来发电过程中,没有生成新物质,是化学变化;D、海水淡化过程中,没有生成新物质,是物理变化。故选:C。2(2分)小洋同学的午餐已有米饭、糖醋排骨、麻辣豆腐三种食物,从营养均衡的角度考虑,小洋应该增加的食物是()A红烧鱼B炒青菜C蒸馒头D煮鸡蛋【分析】根据人体所需六大营养素的种类、食物来源和合理膳食的原则,结合题中所给的食谱判断所含的营养素以及缺少的营养素,进行分析解答。【解答】解:人体需要的六大营养物质
14、:蛋白质、糖类、油脂、维生素、无机盐和水;结合题意,米饭中富含淀粉,淀粉属于糖类;糖醋排骨、麻辣豆腐中含有油脂、蛋白质和无机盐,可知食物中维生素含量较少;故为使营养搭配更加合理,需要补充富含维生素的食物。A、红烧鱼中富含蛋白质,故选项错误。B、炒青菜中富含维生素,故选项正确。C、蒸馒头中富含淀粉,淀粉属于糖类,故选项错误。D、煮鸡蛋中富含蛋白质,故选项错误。故选:B。3(2分)化学科学的发展促进了人类社会的进步,提高了人们的生活品质。请你用学过的化学知识分析下列问题,其中正确的是()A合金、塑料、合成纤维等都属于有机合成高分子材料B利用化学反应中的能量转化,人类可以开发新的能源C常用钢丝球擦洗
15、铝锅,可以使铝锅光亮洁净、更加耐用D化石燃料的使用导致空气中的 CO2 增多,是形成酸雨的主要原因【分析】A根据材料的分类来分析;B根据能源的开发来分析;C根据铝的化学性质来分析;D根据大气中二氧化碳含量过高的危害来分析。【解答】解:A合金属于金属材料,故错误;B利用化学反应中的能量转化,人类可以开发新的能源,故正确;C钢丝球不能用来擦铝锅,否则会把铝锅表面的氧化铝保护膜擦掉,故错误;D化石燃料的使用导致空气中的 CO2 增多,是形成温室效应的主要原因,故错误。故选:B。4(2分)某大学发生的“铊中毒案”使许多人知道了铊(音 t)元素。铊元素可以造成以神经系统损害为主的全身性疾病。如图是元素周
16、期表中铊元素的相关信息,据此分析下列说法中错误的是()A铊元素是一种非金属元素B铊原子核内有81个质子C铊元素的相对原子质量是204.4D铊元素组成单质的化学式为Tl【分析】元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;原子中,核电荷数核内质子数核外电子数原子序数;除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁;相对原子质量质子数+中子数,单位不是g。【解答】解:A、铊元素是一种金属元素,该选项说法不正确;B、铊原子核内有 81 个质子,该选项说法正确;C、铊元素的相对原子质量是 204.4,该选项说法正确;D、铊元素组成单质的化学式
17、为 Tl,该选项说法正确。故选:A.5(2分)学好化学实验基本操作,可以正确、安全地进行实验并获得可靠的结论,下列实验操作中正确的是()A蒸发食盐水B氧气验满C加热液体DCO还原CuO【分析】A、根据蒸发操作的注意事项进行分析判断。B、根据氧气的验满方法进行分析判断。C、根据给试管中的液体加热的方法进行分析判断。D、根据一氧化碳还原氧化铜的注意事项,进行分析判断。【解答】解:A、蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅,图中所示操作正确。B、检验氧气是否收集满时,应将带火星的木条放在集气瓶口,不能伸入瓶中,图中所示操作错误。C、给试管中的液体加热时,用酒精灯的外焰加热试管里
18、的液体,且液体体积不能超过试管容积的,图中液体超过试管容积的、大拇指不能放在短柄上,图中所示操作错误。D、一氧化碳还原氧化铜时,一氧化碳有毒,应在玻璃管中进行,不能在试管中进行,图中所示操作错误。故选:A。6(2分)许多植物的果实、根、茎里都富含淀粉,淀粉的化学式可用(C6H10O5)n表示,n为一个很大的数。则关于淀粉的下列说法错误的是()A淀粉属于人体必需的六大类营养素之一B淀粉充分燃烧后只生成二氧化碳和水C淀粉中碳、氢、氧原子个数比为6:10:5D淀粉的相对分子质量是162【分析】A根据淀粉属于糖类进行分析;B根据淀粉的组成元素进行分析;C根据淀粉的化学式进行分析;D根据相对分子质量的计
19、算方法进行分析。【解答】解除:A淀粉属于糖类,是六大营养素之一,故A正确;B淀粉中只含有C、H、O三种元素,充分燃烧后只生成二氧化碳和水,故B正确;C淀粉的化学式为:(C6H10O5)n,碳、氢、氧原子个数比为 6:10:5,故C正确;D淀粉的相对分子质量是 162n,故D错误。故选:D.7(2分)浙江大学课题组近日制备出了一种只含碳元素的超轻气凝胶,如图是超 轻气凝胶放在桃花的花蕊上。气凝胶由碳原子构成,内部有无数个孔隙,充斥空气,故而得名。下列关于超轻气凝胶说法不正确的是()A气凝胶常温下化学性质稳定B气凝胶具有很强的吸附作用C气凝胶可以用来净化被污染的水源D气凝胶化学性质和金刚石差异很大
20、【分析】A、根据气凝胶由碳原子构成,进行分析判断。B、根据气凝胶内部有无数个孔隙,充斥空气,进行分析判断。C、根据气凝胶具有吸附性,进行分析判断。D、根据气凝胶和金刚石均是碳元素形成的单质,进行分析判断。【解答】解:A、气凝胶由碳原子构成,是碳元素形成的单质,气凝胶常温下化学性质稳定,故选项说法正确。B、气凝胶内部有无数个孔隙,充斥空气,具有疏松多孔的结构,具有很强的吸附作用,故选项说法正确。C、由B选项的分析,气凝胶具有吸附性,可以用来净化被污染的水源,故选项说法正确。D、气凝胶和金刚石均是碳元素形成的单质,化学性质相同,故选项说法错误。故选:D。8(2分)乙二醇是重要化工原料。我省有丰富的


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2019 2020 学年 安徽省 合肥 五十 九年级 第三次 质检 化学 试卷 答案 解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-154449.html