 4.1.3原子结构与元素的性质 学案(含答案)
4.1.3原子结构与元素的性质 学案(含答案)
《4.1.3原子结构与元素的性质 学案(含答案)》由会员分享,可在线阅读,更多相关《4.1.3原子结构与元素的性质 学案(含答案)(8页珍藏版)》请在七七文库上搜索。
1、第第 3 3 课时课时 原子结构与元素的性质原子结构与元素的性质 核心素养发展目标 1.知道碱金属元素、 卤族元素的结构和性质, 能从原子结构角度解释同 主族元素性质的递变规律,形成“结构决定性质”的观念,强化“宏观辨识与微观探析”的 学科核心素养。2.能设计实验方案,探究同主族元素性质的递变性,提升“科学探究与创新 意识”的学科核心素养。 一、元素化学性质与原子最外层电子数的关系 原子 最外层电子数特点 得失电子情况 化学性质 稀有气体元素 都为 8(氦为 2) 不易得失 稳定 金属元素 一般少于 4 易失去 不稳定 非金属元素 多于 4 易得到 不稳定 原子的最外层电子数决定原子的化学性质
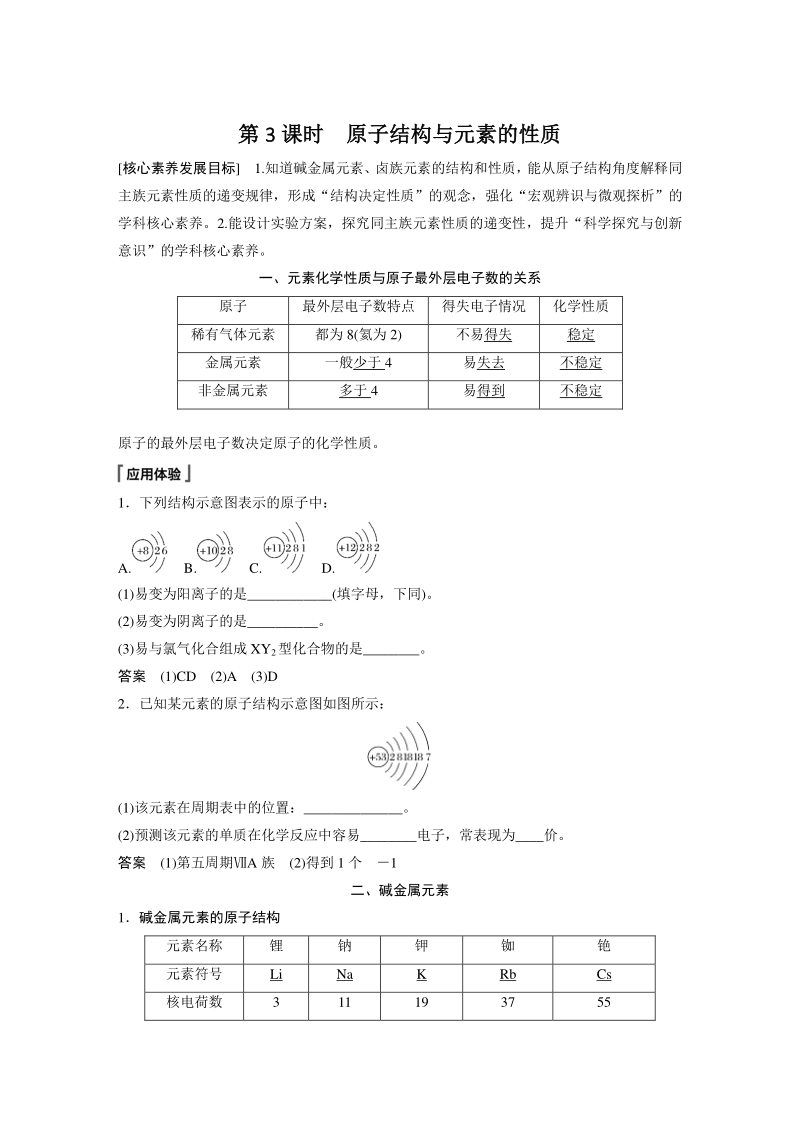
2、。 1下列结构示意图表示的原子中: A. B. C. D. (1)易变为阳离子的是_(填字母,下同)。 (2)易变为阴离子的是_。 (3)易与氯气化合组成 XY2型化合物的是_。 答案 (1)CD (2)A (3)D 2已知某元素的原子结构示意图如图所示: (1)该元素在周期表中的位置:_。 (2)预测该元素的单质在化学反应中容易_电子,常表现为_价。 答案 (1)第五周期A 族 (2)得到 1 个 1 二、碱金属元素 1碱金属元素的原子结构 元素名称 锂 钠 钾 铷 铯 元素符号 Li Na K Rb Cs 核电荷数 3 11 19 37 55 原子结构 示意图 原子半径/nm 0.152
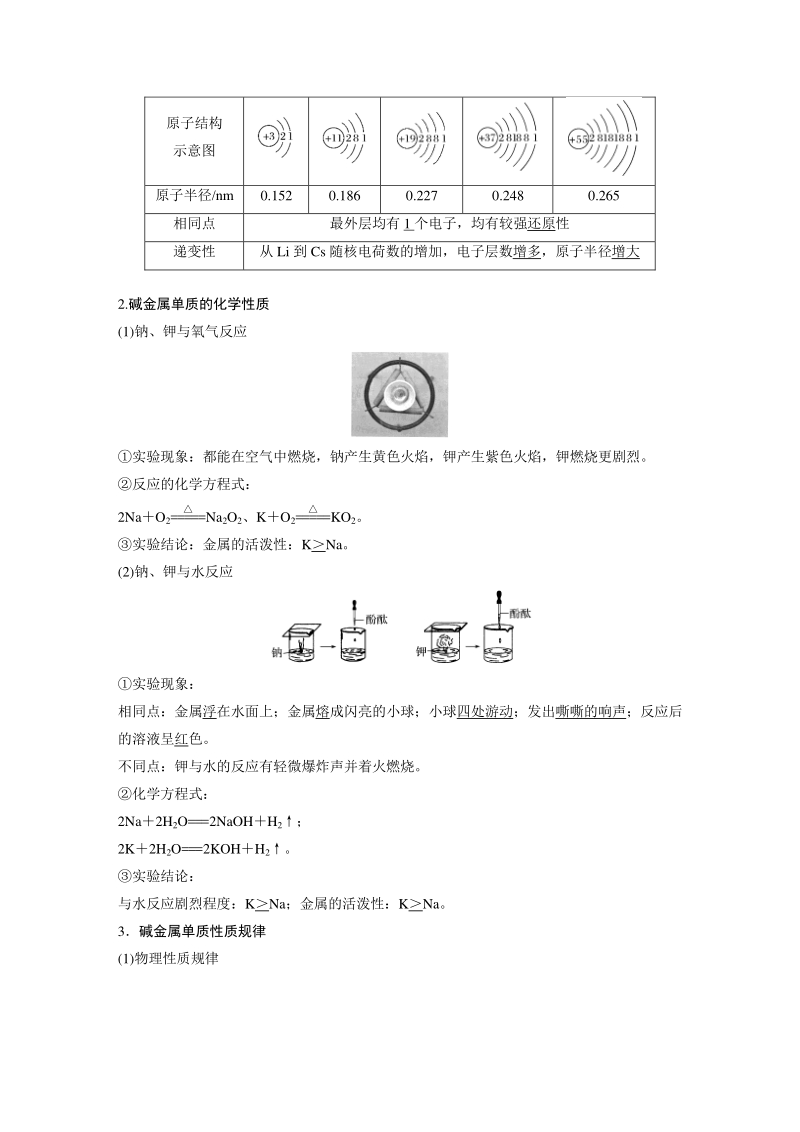
3、0.186 0.227 0.248 0.265 相同点 最外层均有 1 个电子,均有较强还原性 递变性 从 Li 到 Cs 随核电荷数的增加,电子层数增多,原子半径增大 2.碱金属单质的化学性质 (1)钠、钾与氧气反应 实验现象:都能在空气中燃烧,钠产生黄色火焰,钾产生紫色火焰,钾燃烧更剧烈。 反应的化学方程式: 2NaO2= Na2O2、KO2= KO2。 实验结论:金属的活泼性:KNa。 (2)钠、钾与水反应 实验现象: 相同点:金属浮在水面上;金属熔成闪亮的小球;小球四处游动;发出嘶嘶的响声;反应后 的溶液呈红色。 不同点:钾与水的反应有轻微爆炸声并着火燃烧。 化学方程式: 2Na2H2
4、O=2NaOHH2; 2K2H2O=2KOHH2。 实验结论: 与水反应剧烈程度:KNa;金属的活泼性:KNa。 3碱金属单质性质规律 (1)物理性质规律 (2)化学性质的相似性和递变性 相似性 递变性 具体情况如下: a与氧气反应 从 LiCs,与氧气反应越来越剧烈,产物越来越复杂。如 Li 在氧气中燃烧只生成 Li2O,Na 在氧气中燃烧生成 Na2O2,K 在氧气中燃烧生成更复杂的氧化物:KO2。 b与 H2O(或酸)的反应 从 LiCs,与 H2O(或酸)反应越来越剧烈。如 K 与 H2O 反应能发生轻微爆炸,则 Rb、Cs 遇 水会发生剧烈爆炸。 (1)从锂到铯,碱金属元素单质的密度
5、依次增大( ) (2)碱金属元素的单质与氧气反应的产物属于同种类型( ) (3)碱金属元素随核电荷数增大,其单质与水反应越来越剧烈( ) (4)碱金属元素单质都应该保存在煤油中( ) (5)金属钾能从 NaCl 溶液中置换出钠( ) (6)碱金属元素在自然界中能以游离态存在( ) 答案 (1) (2) (3) (4) (5) (6) 1一般情况下,元素的金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度上来判 断,也可以从它们的最高价氧化物对应的水化物氢氧化物的碱性强弱来判断,请写出 LiCs,氢氧化物碱性强弱比较。 提示 LiOHNaOHKOHRbOHBr2I2 振荡静置后,溶液 由无
6、色变为褐色 2I Cl 2=I22Cl 振荡静置后,溶液 由无色变为褐色 2I Br 2=I22Br 4.卤素单质化学性质规律 (1)相似性 卤素原子都能得一个电子 (2)递变性 与 H2反应越来越难,对应氢化物的稳定性逐渐减弱。 Cl2、Br2、I2与 H2O 反应越来越微弱。 (3)熟记卤素的特殊性 在常温下 Br2是唯一的液态非金属单质,易挥发。 碘为紫黑色固体,易升华,淀粉遇 I2变蓝。 氟是最活泼的非金属, 没有正化合价, 氟单质与盐溶液反应时, 先与水反应产生 HF 和 O2。 (1)卤素单质都是双原子分子( ) (2)单质 At2是白色固体( ) (3)同主族的单质熔、沸点一定是

- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 4.1
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-154086.html