 江苏省苏州高新区2020年初中毕业暨升学考试模拟化学试卷(含答案)
江苏省苏州高新区2020年初中毕业暨升学考试模拟化学试卷(含答案)
《江苏省苏州高新区2020年初中毕业暨升学考试模拟化学试卷(含答案)》由会员分享,可在线阅读,更多相关《江苏省苏州高新区2020年初中毕业暨升学考试模拟化学试卷(含答案)(10页珍藏版)》请在七七文库上搜索。
1、1 2020 届初中毕业暨升学考试模拟试卷届初中毕业暨升学考试模拟试卷 化学化学 2020. 05 注意事项注意事项: 1.本试卷分选择题和非选择题,共 28 题,满分 100 分;考试用时 100 分钟。 2.答题前,考生务必将自己的姓名、考点名称、考场号、座位号、考试号填写清楚,并用 2B 铅笔认真正确填涂考试号下方的数字。 3.答选择题必须用 2B 铅笔把答题卡上对应题目的答案标号涂黑,如需改动,请用橡皮擦干净 后, 再选涂其他答案;答非选择题必须用 0.5 毫米黑色墨水签字笔写在答题卡指定的位置上, 不在答题区域内的答案一律无效,不得用其他笔答题。 4.考生答题必须答在答题卡上,答在试
2、卷和草稿纸上一律无效。 可能用到的相对原子质量:H1 C12 O16 I127 选择题(共 40 分) 单项选择题单项选择题(包括 20 小题,每题 2 分,共 40 分。每题只有一个 选项符合题意。) 1.十天建成火神山医院离不开下列化学材料,下列说法不 正确的是 A.墙体采用的岩棉板是无机纤维板,属于无机非金属材料 B.屋面板设计采用上下层玻璃钢夹芯板,属于复合材料 C.净化通风管道系统采用热镀锌钢板,属于复合材料 D.地板设计上选用 PVC 塑胶地板,属于有机合成材料 2.下列过程属于化学变化的是 A.风力发电 B.干冰升华 C.石墨转化成金刚石 D.蔗糖溶解 3.下列物质由离子构成的是
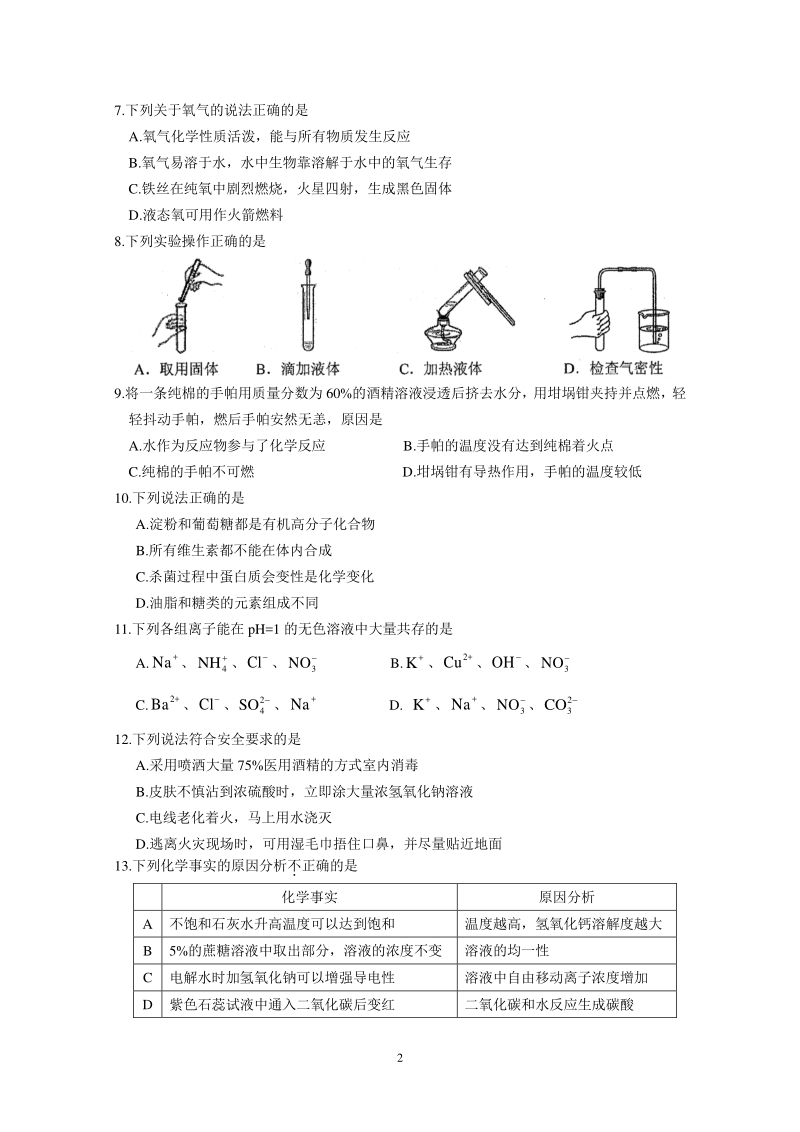
3、 A.二氧化碳 B.硝酸钾 C.氧气 D.水银 4.下列化肥属于复合肥的是 A. K2CO3 B. CO(NH2)2 C. Ca3(PO4)2 D. NH4H2PO4 5.下列物质按照混合物、氧化物、单质顺序排列的是 A.空气、二氧化锰、氧气 B.海水、氯酸钾、氢气 C.氧化铁、锰酸钾、水 D.硫酸铜、高锰酸钾、二氧化碳 6.下列有关化学用语表示正确的是 A.2 个氧原子:O2 B.钠原子结构示意图: C.2 个铁离子:2Fe2+ D.硫酸铝中硫元素的化合价: +6 243 Al (SO ) 2 7.下列关于氧气的说法正确的是 A.氧气化学性质活泼,能与所有物质发生反应 B.氧气易溶于水,水中
4、生物靠溶解于水中的氧气生存 C.铁丝在纯氧中剧烈燃烧,火星四射,生成黑色固体 D.液态氧可用作火箭燃料 8.下列实验操作正确的是 9.将一条纯棉的手帕用质量分数为 60%的酒精溶液浸透后挤去水分,用坩埚钳夹持并点燃,轻 轻抖动手帕,燃后手帕安然无恙,原因是 A.水作为反应物参与了化学反应 B.手帕的温度没有达到纯棉着火点 C.纯棉的手帕不可燃 D.坩埚钳有导热作用,手帕的温度较低 10.下列说法正确的是 A.淀粉和葡萄糖都是有机高分子化合物 B.所有维生素都不能在体内合成 C.杀菌过程中蛋白质会变性是化学变化 D.油脂和糖类的元素组成不同 11.下列各组离子能在 pH=1 的无色溶液中大量共存
5、的是 A. + Na、 4 NH、Cl、 3 NO B. + K、 2+ Cu、OH 、 3 NO C. 2+ Ba、Cl、 2 4 SO 、 + Na D. + K、 + Na、 3 NO、 2 3 CO 12.下列说法符合安全要求的是 A.采用喷洒大量 75%医用酒精的方式室内消毒 B.皮肤不慎沾到浓硫酸时,立即涂大量浓氢氧化钠溶液 C.电线老化着火,马上用水浇灭 D.逃离火灾现场时,可用湿毛巾捂住口鼻,并尽量贴近地面 13.下列化学事实的原因分析不 正确的是 化学事实 原因分析 A 不饱和石灰水升高温度可以达到饱和 温度越高,氢氧化钙溶解度越大 B 5%的蔗糖溶液中取出部分,溶液的浓度不
6、变 溶液的均一性 C 电解水时加氢氧化钠可以增强导电性 溶液中自由移动离子浓度增加 D 紫色石蕊试液中通入二氧化碳后变红 二氧化碳和水反应生成碳酸 3 14.下列有关宏观现象的微观解释正确的是 A.将氧气制成液氧分子体积变小 B.氢气在氧气中燃烧生成水化学反应中分子和原子都可以再分 C. 75mL 的酒精和 25mL 的水混合后体积小于 100 mL分子间有间隔 D.食物变质食物中的分子种类不变,但分子的性质发生了变化 15.天工开物中有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用 煤炭饼垫盛,其底铺薪,发火锻红,罐中炉甘石熔化成团。 ”(注:炉甘石的主要成分是碳酸 锌。)
7、火法炼锌主要发生的化学反应是:2C+ZnCO3= 高温 Zn+2X,下列说法不 正确的是 A. X 的化学式是 CO B.反应前后固体的质量不变 C.该反应是置换反应 D.该反应部分元素的化合价发生改变 16.下列实验操作不能达到实验目的是 选项 实验目的 实验操作 A 除去 CuSO4溶液中的 H2SO4 加入过量铁粉,过滤 B 除去 H2中少量的 HCl 气体 将混合气体通过浓氢氧化钠溶液 C 鉴别棉线和羊毛线 点燃后,闻气味 D 鉴别 NaCl 和 NH4NO3固体 分别加少量水溶解 17.下列推理正确的是 A.氖原子核外电子数为 10,核外电子数为 10 的微粒一定是氖原子 B.单质由
8、同种元素组成,由同种元素组成的纯净物一定是单质 C.酸碱中和反应生成盐和水,生成盐和水的反应一定是中和反应 D.有机化合物含碳元素,含碳元素的化合物一定是有机化合物 18. NH4Cl 和 NaCl 的溶解度随温度变化如图,下列说法 正确的是 A. NH4Cl 的溶解度一定大于 NaCl B.将 NaCl 溶液降温一定会有 NaCl 固体析出 C . 50时 NH4Cl 饱和溶液的溶质质量分数为 50% D.将 t 时 NH4Cl 和 NaCl 的饱和溶液加热至 50, 两 溶液的溶质质量分数相等 19.下列是关于某些工业生产中涉及的化学反应,每个“”都表示该变化可以通过一步反应 实现,其中有
9、不 正确的是 A.“苛化法”制烧碱:NaClNa2CO3NaOH B.熟石灰的生产过程:CaCO3CaOCa(OH)2 C.用铜矿石湿法炼铜:Cu2(OH)2CO3CuCl2Cu D.炼铁高炉中的变化:CCO2CO 20.“暖宝宝贴”(主要成分为铁粉)的热量来源于铁粉的锈蚀反应。用“暖宝宝贴”测定空气中 氧气的含量,实验开始前装置如图所示,实验后从量筒中进入广口瓶(容积为 250 mL)中水 4 的体积为 45 mL(铁粉锈蚀消耗的水忽略不计).下列叙述不 正确的是 A.实验前必须检查装置的气密性 B.本次实验测得空气中氧气的体积分数为 18% C.若测得空气中氧气含量偏低,可能是铁粉不足 D
10、.必须等温度计的读数恢复至实验前的温度后,才能记录量筒内剩余水的体积 非选择题(共 60 分) 21. (8 分)“砂锅鱼头”汤鲜汁浓,其烹饪方法为:将鱼头下油锅煎黄后,放入砂锅中加适量食 盐、葱段、生姜、香菜、矿泉水等,在火上煨煮数小时即成。 (1)鱼头中的蛋白质进入人体后会逐步分解成被人体吸收的 。 (2)“砂锅鱼头”中几乎不含有的营养素是 (填序号)。 A. 无机盐 B.油脂 C.糖类 D.水 (3)鱼肉中富含铁、 钙、 磷等多种元素, 青少年摄入 元素可预防佝偻病和发育不良。 (4)液化气灶主要成分是丙烷(C3H8)煨制鱼头的砂锅外壁常因丙烷的 (填“完全” , 或 “不完全”)燃烧产
11、生黑灰,将灶具的进风口 (填“调大”或“调小”)可以 避免黑灰 产生。 (5)用洗洁精清洗油腻的砂锅是利用洗洁精的 作用。 (6)新型冠状病毒蔓延期间,外出买鱼需佩戴符合要求的口罩。佩戴口罩预防病毒的原理相 当于化学实验中的 操作。活性炭口罩能有效阻隔空气中的氨、苯、甲醛等有害 气体,其功能比普通口罩强大,因为活性炭具有 性。 22. (6 分)波尔多液是农业上常用的杀菌剂, 配制波尔多液的主要原料有生石灰和硫酸铜, 在配 制和使用时有诸多注意事项。 (1)配制时:先将生石灰、硫酸铜分别溶于水,该过程发生反应的化学方程式是 ,然 后将所得的硫酸铜溶液缓慢倒入石灰乳中,即得到波尔多液,若将石灰乳


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 江苏省 苏州 高新区 2020 年初 毕业 升学考试 模拟 化学 试卷 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-141055.html