 2020年初中化学同步讲义第10单元 单元检测试卷(含详细解答)
2020年初中化学同步讲义第10单元 单元检测试卷(含详细解答)
《2020年初中化学同步讲义第10单元 单元检测试卷(含详细解答)》由会员分享,可在线阅读,更多相关《2020年初中化学同步讲义第10单元 单元检测试卷(含详细解答)(14页珍藏版)》请在七七文库上搜索。
1、 第十单元第十单元 酸和碱酸和碱 单元检测单元检测 (满分:100 分,时间:60 分钟,考试方式:闭卷) 注意事项:注意事项: 1本试卷分第 I 卷(选择题)和第 II 卷(非选择题)两部分。 2回答第 I 卷时,选出每小题答案后,将答案答在第 II 卷前的答题表中。 3回答第 II 卷时,将答案直接写在本试卷上。 第第卷卷 一、选择题:本题共一、选择题:本题共 14 个小题,每小题个小题,每小题 3 分,共分,共 42 分。在每小题给出的四个选项中,只有一项是符合题分。在每小题给出的四个选项中,只有一项是符合题 目要求的。目要求的。 1 (2018重庆 A)安全事故无小事。下图是一种危险化
2、学品警示标记,在运输时应张贴该标记的是 A食盐 B鞭炮 C烧碱 D酒精 2下列选项中物质的名称,俗名,化学式不一致的是 A银 水银 Hg B氢氧化钙 熟石灰 Ca(OH)2 C氧化钙 生石灰 CaO D氢氧化钠 苛性钠 NaOH 3 (2018沈阳)下列描述属于氢氧化钙化学性质的是 A白色固体 B微溶于水 C溶液有滑腻感 D能与 CO2反应 4某同学用 pH 计测得生活中一些物质的 pH,得到下表,下列说法错误的是 物质 肥皂水 牙膏 西瓜汁 食醋 pH 10.2 8.5 5.8 2.4 A牙膏显碱性 B西瓜汁的酸性比食醋的酸性强 C肥皂水中滴入紫色石蕊试液显蓝色 D胃酸过多的人不宜食用过多的
3、食醋 5 (2018恩施)下列关于氢氧化钠的描述中错误的是 A可用于改良酸性土壤 B易溶于水,溶解时放出大量的热 C能去除油污,可作炉具清洁剂 D对皮肤有强烈的腐蚀作用 6下列关于物质的组成、结构、性质及变化规律的总结,正确的是 AC、CO、CO2组成中都含有碳元素,故参与反应时均具有碳的还原性 BHCl 和 NaOH 反应生成了盐和水,故有盐和水生成的反应都是中和反应 C酸溶液都含有 H+,故酸都有相似的化学性质 D浓 H2SO4、NaOH 都具有吸水性,故它们都能用来干燥二氧化碳气体 7下列四种变化中,与其他三种变化有本质区别的是 A生石灰放置在潮湿的空气中,质量增加 B浓盐酸敞口放置在空
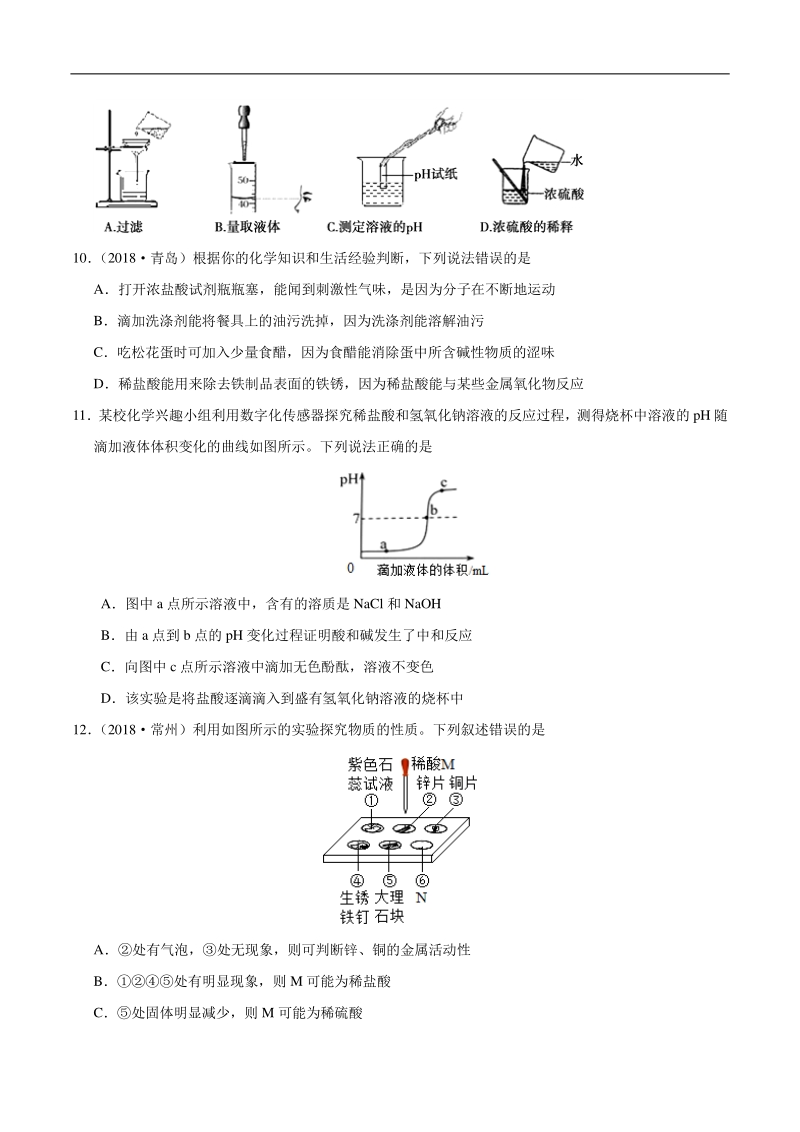
4、气中,质量减少 C氢氧化钠固体暴露在空气中,质量增加 D硫酸铜晶体受热,颜色改变,质量减少 8向 X 溶液中不断加入 Y,下列各组实验与图中所示关系相符的一组是 9下列实验操作中,正确的是 10 (2018青岛)根据你的化学知识和生活经验判断,下列说法错误的是 A打开浓盐酸试剂瓶瓶塞,能闻到刺激性气味,是因为分子在不断地运动 B滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污 C吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味 D稀盐酸能用来除去铁制品表面的铁锈,因为稀盐酸能与某些金属氧化物反应 11某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯
5、中溶液的 pH 随 滴加液体体积变化的曲线如图所示。下列说法正确的是 A图中 a 点所示溶液中,含有的溶质是 NaCl 和 NaOH B由 a 点到 b 点的 pH 变化过程证明酸和碱发生了中和反应 C向图中 c 点所示溶液中滴加无色酚酞,溶液不变色 D该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中 12 (2018常州)利用如图所示的实验探究物质的性质。下列叙述错误的是 A处有气泡,处无现象,则可判断锌、铜的金属活动性 B处有明显现象,则 M 可能为稀盐酸 C处固体明显减少,则 M 可能为稀硫酸 D处反应放热,则 N 可能是氢氧化钠溶液 13取一定质量 Fe2O3 与 Al2O3的混合物,
6、恰好和 100 g 质量分数为 9.8稀硫酸完全反应,原混合物中氧 元素的质量是 A0.8 g B1.6 g C1.8 g D3.6 g 14 (2018南京)下图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。 下列说法正确的是 A在 a、b、c 三种曲线所示的实验中,所用盐酸浓度越大,V 时所得溶液的 pH 越大 B在 a 曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色 C在 a、b、c 三种曲线所示的实验中,反应速率相同 D在 a、b、c 三种曲线所示的实验中,溶液酸性由强到弱的顺序是 abc 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 答
7、案 第第卷卷 二、非选择题:本题包括二、非选择题:本题包括 5 个小题,共个小题,共 58 分。分。 15 (8 分)如图所示的实验能验证水的组成: (1)接通直流电源一段时间后,玻璃管 b 内产生的气体是_,该管内产生约 4 g 气体时,玻璃 管 a 内产生约_g 气体。 (2)上述实验说明水是由_组成的。 (3)该实验中,往电解器玻璃管里加满含有酚酞的硫酸钠溶液(硫酸钠只增强导电性,不发生反应) 。 在实验过程中, 观察到管 a 电极附近的溶液迅速变红, 则该处溶液呈_ (填“酸” “碱”或“中” ) 性。 电解后, 待溶液混合均匀后测得溶液的 pH=7, 说明电解时管 b 电极附近的溶液
8、呈_ (填 “酸” “碱”或“中” )性。 (4)该实验中,若水中加入少量硫酸以增强导电性,硫酸不发生反应,则电解后溶液的 pH_ (填“增大” “减小”或“不变” ) 。 16 (8 分) 归纳总结是学习化学的重要方法, 小明同学用如图所示的内容总结了 NaOH 的四条化学性质 (即 NaOH 与四类物质能够发生化学反应) 。 (1)为了验证反应,小明将_试液滴入 NaOH 溶液中,溶液变成_色。 (2)依据反应NaOH 必须密封保存,否则在空气中要变质,其化学反应方程式为_ _。 (3)写出一个能发生反应的化学方程式:_。 (4)反应中盐若为硫酸铜,则反应的现象为_。 17 (16 分)
9、(2018阜新)中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱 中和反应进行了如下研究。 【实验过程 1】 对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了 化学反应,可通过下图所示实验步骤进行操作。 请根据上图所示实验步骤填写实验报告: 实验步骤 实验现象 实验结论 向试管中加入 12 mL 稀氢氧 化钠溶液 NaOH 与 HCl 发生了 中和反应 _ _ _ _ 【实验过程 2】 对于某些有明显现象产生的中和反应,如稀盐酸与氢氧化铝的反应,观察到有_ 的现象,就可以说明中和反应已经发生。该反应的化学方程式为_ _。 提 示:氢氧
10、化铝是不溶于水的白色固体 ,其化学式为 Al(OH)3 【实验反思】 (1)有同学提出也可以使用石蕊溶液代替酚酞溶液进行(实验过程 1)的实验。你认为_ _(填“酚酞溶液”或“石蕊溶液” )更适合用于验证稀盐酸与稀氢氧化钠溶液发生中和反应,你的 理由是_。 (2)对于没有明显现象出现的酸碱中和反应,我们可以借助_的变化, 来判断是否反应或反应进行的程度。 18 (14 分)某兴趣小组在探究浓硫酸的化学性质时,将浓硫酸滴加到氯化钠固体中并小心的加热,发现有 剌激性气味的气体产生,同时发现有白雾,经査资料了解到浓硫酸与氯化钠在加热时会发生反应,写 出该反应的化学方程式:_,该兴趣小组对产生的氯化氢
11、(HCl) 气体是否显酸性进行了相关探究。 【进行实验】同学们根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸 质干燥小花进行如图 1 的三个实验: 【实验现象】和中小花不变色;中小花变红色。 【査阅资料】图 2 是同学们査阅的氯化氢气体溶于水的示意图。 【实验结论】氯化氢气体不显酸性。 【交流反思】 (1)从微观角度分析氯化氢气体不显酸性的原因是_。 (2)小明向实验中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反 应的化学方程式:_。 (3)紫甘蓝的汁液在酸性溶液中显_色。 (4)下列实验可以用来说明氯化氢气体不显酸性的是_(填字母序号) 。
12、A测试盐酸的导电性,盐酸能导电 B干燥的碳酸钠粉末放入氯化氢气体中,不反应 C氢气与氯气反应,生成氯化氢气体 D干燥的碳酸钠粉末放入盐酸中,能反应 【拓展应用】 同学们为探究分子的运动情况,在玻璃管两端同时放入蘸有试剂的棉花,做了如图 3 所示实验,发现 在玻璃管内形成了白色烟环(成分为氯化铵)且偏向蘸有浓盐酸的棉花一端。 白色烟环偏向蘸有浓盐酸的棉花一端的原因是_。 写出该反应的化学方程式:_。 19 (12 分)实验室常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化 钾溶液来处理酸性废水。 (1)定性检测废水 检测废水呈酸性的方法是_。 (2)配制 200 g
13、质量分数为 5.6%的氢氧化钾溶液 计算 m(KOH)=_g,V(H2O)=_mL(水的密度近似为 1.0 g mL-1) 。 称取氢氧化钾 调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后_(按操作先后 顺序,填字母) ,直至天平平衡。 A向烧杯中加氢氧化钾同体 B按需要添加砝码、移动游码 量取水;溶解;转移。 (3)定量测定废水 取酸性废水样品 100 g,逐滴加入 5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如下图所示。 (假设废水中其他成分不与氢氧化钾反应且不含硫酸钾) P 点对应溶液中一定存在的阳离子有_(填离子符号) 。 酸性废水中硫酸的质量分数为_(用百分数


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020年初中化学同步讲义第10单元 单元检测试卷含详细解答 2020 年初 化学 同步 讲义 10 单元 检测 试卷 详细 解答
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 2020年初中化学同步讲义第01单元
- 单元检测试卷含详细解答
- 章末检测试卷下列有关化学用语的表示方法中正确的是
- 英语九年级第十单元单词。
- 初中化学第十单元知识点
- 初中化学 实验计划
- 第10单元
- 2020年初中化学同步讲义第06单元
- 2020年初中化学同步讲义第09单元
- 2020年初中化学同步讲义第04单元
- 2020年初中化学同步讲义第11单元
- 2020年初中化学同步讲义第02单元 单元检测试卷含详细解答
- 2020年初中化学同步讲义第10单元 单元检测试卷含详细解答
- 2020年初中化学同步讲义第02单元
- 2020年初中化学同步讲义第07单元 单元检测试卷含详细解答
- 2020年初中化学同步讲义第10单元
- 2020年初中化学同步讲义第05单元 单元检测试卷含详细解答
- 2020年初中化学同步讲义第01单元 单元检测试卷含详细解答
- 2020年初中化学同步讲义第05单元



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-136035.html