 2020年初中化学同步讲义专题8.2 金属的化学性质
2020年初中化学同步讲义专题8.2 金属的化学性质
《2020年初中化学同步讲义专题8.2 金属的化学性质》由会员分享,可在线阅读,更多相关《2020年初中化学同步讲义专题8.2 金属的化学性质(20页珍藏版)》请在七七文库上搜索。
1、 第第八八单元单元 金属和金属材料金属和金属材料 课题课题 2 金属的化学性质金属的化学性质 一、一、金属与氧气的反应金属与氧气的反应 1铁与氧气的反应 (1)常温下很难反应,但在_能与氧气反应。 (2)反应现象:_。 (3)反应方程式为_,反应类型是_。 2铜与氧气的反应 (1)常温下很难反应,但在_能与氧气反应。 (2)反应现象:_。 (3)反应方程式为_,反应类型是_。 3铝与氧气的反应 (1)常温下就能与氧气反应,形成一层致密的_薄膜,从而阻止铝进一步氧化,因此,铝具有 很好的_性能。 (2)反应方程式为_,反应类型是_。 4镁与氧气的反应 (1)常温下就能与氧气反应,形成一层致密的_
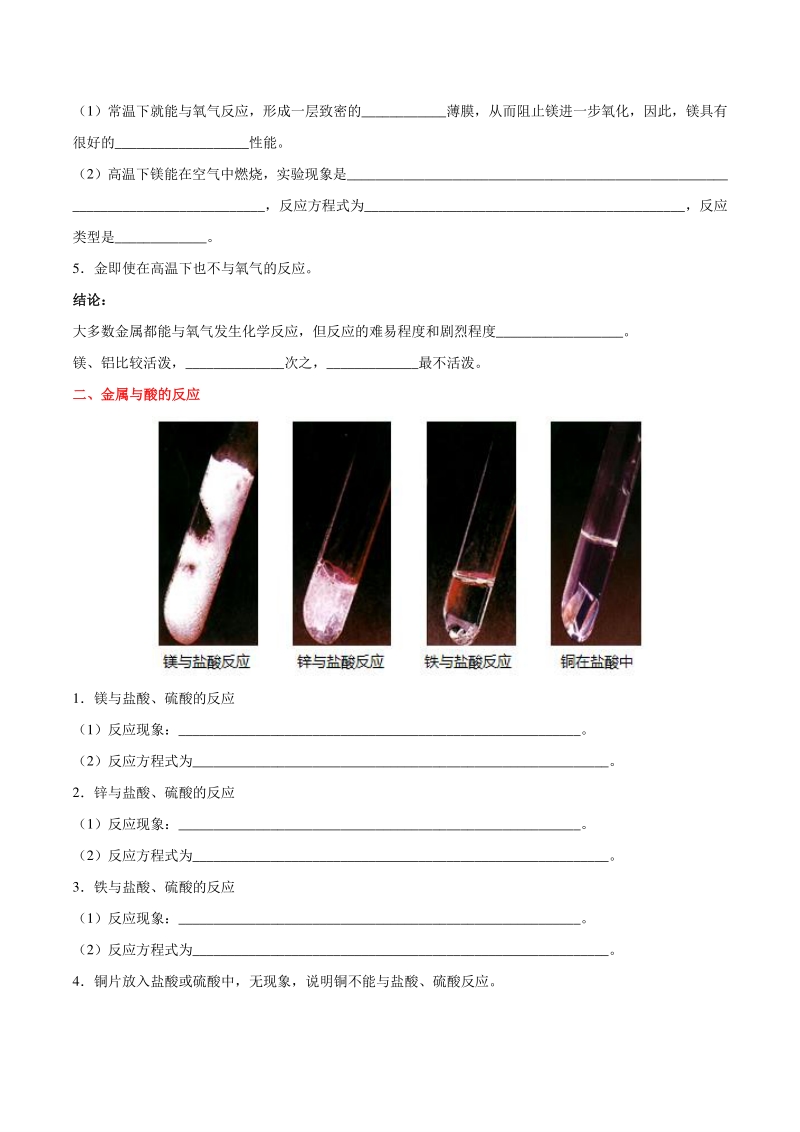
2、薄膜,从而阻止镁进一步氧化,因此,镁具有 很好的_性能。 (2)高温下镁能在空气中燃烧,实验现象是_ _,反应方程式为_,反应 类型是_。 5金即使在高温下也不与氧气的反应。 结论:结论: 大多数金属都能与氧气发生化学反应,但反应的难易程度和剧烈程度_。 镁、铝比较活泼,_次之,_最不活泼。 二二、金属与酸的反应金属与酸的反应 1镁与盐酸、硫酸的反应 (1)反应现象:_。 (2)反应方程式为_。 2锌与盐酸、硫酸的反应 (1)反应现象:_。 (2)反应方程式为_。 3铁与盐酸、硫酸的反应 (1)反应现象:_。 (2)反应方程式为_。 4铜片放入盐酸或硫酸中,无现象,说明铜不能与盐酸、硫酸反应。
3、 根据上述实验及上图可知金属的活泼性:镁_锌_铁_铜。 三三、金属活动性顺序金属活动性顺序 1金属与化合物(盐)溶液的反应 (1)铁与硫酸铜溶液的反应 现象:铁表面有_生成,溶液由蓝色变为浅绿色。 反应方程式:_。 (2)铝与硫酸铜溶液的反应 现象:铝表面有_生成,溶液由蓝色变为无色。 反应方程式:_。 (3)铜与硝酸银溶液的反应 现象:铜表面有_生成,溶液由无色变为蓝色。 反应方程式:_。 2金属活动性顺序 (1)规律 (2)意义 在金属活动性顺序表中: 金属的位置越靠前,它的活动性就越_。 位于氢前面的金属能置换出盐酸、稀硫酸(不可以用浓硫酸和硝酸)中的_。 位于前面的金属(钾、钙、钠除外
4、)能把位于后面的金属从它们化合物的溶液里_出来。当金 属与两种以上盐溶液反应时,优先置换出_的金属。即:前置后,盐可溶,钾、钙、钠除外,不 活泼金属的盐溶液优先。 四四、置换反应置换反应 1定义:由一种单质与一种化合物反应,生成_的反应叫 置换反应。 2特点:A+BCAC+B 或 A+BCBA+C。 一、1 (1)高温下 (2)剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体 (3)3Fe+2O2Fe3O4 氧化反应或化合反应 2 (1)高温下 (2)铜丝在空气中加热表面变黑,失去金属光泽 (3)2Cu+O22CuO 氧化反应或化合反应 3 (1)氧化铝 抗腐蚀 (2)4Al+3O22Al2
5、O3 氧化反应或化合反应 4 (1)氧化镁 抗腐蚀 (2)发出耀眼的白光,放出大量的热 2Mg+O22MgO 氧化反应或化合反应 结论:结论:不相同 铁、铜 金 二、1 (1)反应剧烈,产生大量的气泡,溶液仍为无色 (2)Mg+2HClMgCl2+H2或 Mg+H2SO4MgSO4+H2 2 (1)反应比较剧烈,产生较多的气泡,溶液仍为无色 (2)Zn+2HClZnCl2+H2或 Zn+H2SO4ZnSO4+H2 3 (1)反应缓慢,有少量的气泡产生,溶液由无色变为浅绿色 (2)Fe+2HClFeCl2+H2或 Fe+H2SO4FeSO4+H2 4 三、1 (1)紫红色固体 Fe+CuSO4F
6、eSO4+Cu (2)紫红色固体 2Al+3CuSO4Al2(SO4)3+3Cu (3)银白色固体 Cu+2AgNO3Cu(NO3)2+2Ag 2 (2)强 氢 置换 最不活泼 四、1另一种单质和另一种化合物 一、实验室一、实验室制取氢气药品选择的探究制取氢气药品选择的探究 1金属活动性比氢强的金属,都能将盐酸或硫酸中的氢离子给置换出来,生成氢气,金属活动性比氢弱的 金属,不能与盐酸或硫酸反应,不能生成氢气。 2选择药品时,要考虑:经济性要好、反应速度要适中、便于收集、气体要纯净。 结论:结论:在实验室里制取氢气,选用锌与稀盐酸或稀硫酸,不能选择浓盐酸,也不能选用镁、铁等金属。实 验室制取氢气
7、的最佳药品是用锌和稀盐酸或稀硫酸反应,该反应速率适中、药品价格廉价易得,制得的气 体比较纯净。镁与盐酸反应速率过快,氢气不便于收集;铁与盐酸反应速率太慢,浪费时间。 二、金属活动性的判断依据二、金属活动性的判断依据 判断依据 结论 根据金属能否与酸溶液反应产生氢气来判断 若能反应,则该金属在金属活动性顺序中位于氢前 面,否则位于氢后面 根据金属与酸溶液反应的剧烈程度来判断 剧烈程度强的金属较活泼 根据金属A与另一种金属B的化合物溶液能否发生 置换来判断 若 A 能置换 B,则 A 的活动性比 B 强;反之则比 B 弱 三三、化合反应、化合反应、分解反应分解反应、置换反应的比较置换反应的比较 反
8、应类型 特点 举例 简单表示 化合反应 多变一 2H2O22H2O A+B+C 分解反应 一变多 2H2O22H2OO2 AC+B+ 置换反应 一换一 H2SO4ZnZnSO4H2 A+BCB+AC 【特别提醒】由于置换反应是单质与化合物反应生成新的单质和新的化合物,单质中元素的化合价为 0,化 合物中元素的化合价不为 0,因此置换反应中一定有元素化合价发生变化。 四、四、金属与酸的反应图像金属与酸的反应图像 1等质氢图 两种金属反应产生的氢气质量相同,此图反映了两种情况: (1)酸不足,金属过量,产生的氢气质量由酸的质量决定。 (2)酸足量,产生的氢气质量由金属的质量决定,产生氢气的质量相同
9、。如 18 g 铝和 56 g 铁分别投入足 量的稀硫酸中反应产生的氢气质量相同。 2等质等价金属图 如等质量的镁、铁、锌与足量的酸反应生成的金属离子都为2 价,产生氢气的速率和质量不同。此图反映 出: (1)金属越活泼,曲线越陡,如 Mg 线比 Zn 线陡,Zn 线比 Fe 线陡。 (2)金属的相对原子质量越小,产生氢气越多,曲线的拐点越高,消耗的酸也越多。 可简单概况为“越陡越活,越高越小” 。 3等质不等价金属图 铝、镁、锌与酸反应生成金属离子的化合价分别为3、2、2,产生氢气的质量与金属的化合价、金属 的相对原子质量有关。 4等质等酸氢图 如向等质量的镁、铝、铁、锌中缓慢加入盐酸,金属
10、锌先反应完,消耗的盐酸最少,产生的氢气也最少; 其次是铁反应完,消耗盐酸的量以及产生的氢气增多;然后是金属镁反应完,最后是金属铝。由此可以分 析出向等质量的镁、铝、铁、锌中加入等量的盐酸,产生氢气的量有如下几种情况(加入盐酸的量用 m g 表示) : (1)当 0ma 时,产生氢气的质量:Al=Mg=Fe=Zn。 (2)当 amb 时,产生氢气的质量:Al=Mg=FeZn。 (3)当 bmc 时,产生氢气的质量:Al=MgFeZn。 (4)当 cm 时,产生氢气的质量:AlMgFeZn。 典例典例 1 今年春季,在张献忠沉银考古现场,整齐堆放着金册、银册,金币、银币、铜币和银锭,还有铁 刀、铁
11、矛等兵器。下列说法中错误的是 A“真金不怕火炼”说明了黄金的化学性质稳定 B上述钱币用金、银、铜而不用铁,从化学角度看主要原因是铁的冶炼困难 C自然界有天然的铜、银、金矿藏,却没有天然的金属铁矿藏 D常温下验证铁、铜、银三种金属的活动顺序时,至少需一种金属单质 【解析】 A、 “真金不怕火炼”说明了黄金的化学性质稳定,即使高温下也不与氧气反应;B、 上述钱币用金、 银、铜而不用铁,从化学角度看主要原因是铁的化学性质活泼,易腐蚀;C、自然界有天然的铜、银、金矿 藏,却没有天然的金属铁矿藏,因为铁的化学性质活泼,易发生化学变化,形成化合物;D、在金属活动性 顺序表中金属的位置越靠前,金属的活动性越
12、强。位置靠前的金属能将位于其后的金属从它的盐溶液中置 换出来。常温下验证铁、铜、银三种金属的活动顺序时,至少需一种金属单质,如:铜和硝酸亚铁溶液、 硝酸银溶液反应既能验证三种金属的活动性顺序。故选 B。 【答案】B 典例典例 2 (2018张家界)现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生氢 气,乙不反应;如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙的表面有银析出,而丙没有变化, 根据以上事实,则甲、乙、丙的金属活动性由强到弱的顺序是 A甲乙丙 B乙甲丙 C乙丙甲 D丙乙甲 【解析】甲和乙分别放入稀硫酸中,甲溶解并产生氢气,乙不反应,说明甲的活动性在氢之前,乙的活动
13、 性在氢之后,如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙的表面有银析出,而丙没有变化,说 明乙的活动性比银强,丙的活动性比银弱,所以甲、乙、丙的金属活动性由强到弱的顺序是甲乙丙。 故选 A。 【答案】A 典例典例 3 (2017苏州)下列反应属于置换反应的是 A2CO+O22CO2 BH2CO3H2O+CO2 CNaOH+HClNaCl+H2O D2Al+6HCl2AlCl3+3H2 【解析】置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。A、属化合反应; B、属分解反应;C、未有单质参与和生成,不属与置换反应;D、反应物铝为单质,氯化氢为化合物,生 成物氯化铝属于
14、化合物,氢气属于单质,故该反应为置换反应。故选 D。 【答案】D 典例典例 4 (2018自贡)现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中, 产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2 价) 。则下列说法中 错误的是 A金属活动性:乙甲丙 B生成氢气的质量:甲乙丙 C相对原子质量:乙丙甲 D消耗硫酸的质量:甲乙丙 【解析】A、等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,金属越活泼反 应越快,故金属活动性:乙甲丙,正确;B、由图示可知生成氢气的质量:甲乙丙,正确;C、等 质量甲、乙、丙三种金属,分别放入三
15、份溶质质量分数相同的足量稀硫酸中,说明金属均已全部反应完, 甲、乙、丙在生成物中化合价均为+2 价,生成氢气质量是甲乙丙,则相对原子质量是甲乙丙,错 误;D、消耗硫酸的质量:甲乙丙,氢来源于酸,产生的氢气质量越多,消耗硫酸的质量越多,正确。 故选 C。 【答案】C 1下列金属不能与酸反应生成氢气的是 AMg BAl CFe DCu 2我国明代科学家宋应星所著的天工开物中,详细记述了金、铜、铁、锌等金属的开采和冶炼方法, 记述的四种金属中金属活动性最强的是 A金 B铜 C铁 D锌 3关于金属及其合金的说法正确的是 A自然界中大多数金属以化合物形式存在 B所有金属的颜色都是银白色 C黄铜的硬度比纯
16、铜的硬度小 D生铁可以完全溶解在足量稀盐酸中 4下列物质,不能与铁发生反应的是 A氧气 B硫酸铜溶液 C硫酸锌溶液 D稀硫酸 5将金属 R 放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出。下列关于 R 的金属 活动性判断不正确的是 ARCu BRFe CZnR DRAg 6下列金属中,不能 从 CuSO4溶液中置换出 Cu 的是 AFe BZn CMg DAg 7用实验比较铜、铁、汞的金属活动性,只需选用下列试剂中的 A硫酸亚铁溶液 B硝酸镁溶液 C盐酸 D硫酸铜溶液 8实验室中用如下实验方案(图示)来研究铁、铝、铜三种金属活动性顺序及其在活动性顺序表中相对氢 的位置。 (1
17、)乙实验中,简要叙述把铜片加入到试管中的操作_ _;只要观察到_现象,就证 明二者已经发生反应。 (2)若将实验乙中的 CuSO4溶液替换为_,即可达成实验目的。 (3)还可以用不同的方法来探究这三种金属的金属活动性,写出你所需要的化学试剂_ _。 9有甲、乙、丙三种金属分别与空气和稀硫酸反应,现象如表所示: 甲 乙 丙 空气 剧烈燃烧 变黑 变黑 稀硫酸 有气体 无气体 有气体 根据以上信息,这三种金属活动性由强到弱的顺序是 A甲、丙、乙 B甲、乙、丙 C乙、丙、甲 D丙、乙、甲 10结合图片判断下列说法不正确的是 A图中镁与盐酸的反应速率最快 B图中能体现出四种金属的活动性由弱到强的顺序是


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020 年初 化学 同步 讲义 专题
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-135428.html