 2020高考化学大题专项训练《化学工艺流程题(1)》及答案解析
2020高考化学大题专项训练《化学工艺流程题(1)》及答案解析
《2020高考化学大题专项训练《化学工艺流程题(1)》及答案解析》由会员分享,可在线阅读,更多相关《2020高考化学大题专项训练《化学工艺流程题(1)》及答案解析(13页珍藏版)》请在七七文库上搜索。
1、2020高考化学大题专项训练化学工艺流程题(1)1钼酸钠晶体(Na2MoO42H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:(1)途径I碱浸时发生反应的化学反应方程式为_。(2)途径II氧化时还有Na2SO4生成,则反应的离子方程式为_。(3)已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是_已知Ksp(BaCO3)=110-9、Ksp(BaMoO4)=4.01
2、0-8,忽略溶液的体积变化。(4)分析纯的钼酸钠常用钼酸铵(NH4)2MoO4和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的气体一起通入水中,得到正盐的化学式是_。(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是_。若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mgL-1,则缓蚀效果最好时钼酸钠(M=206g/mol) 的物质的量浓度为_(计算结果保留3位有效数字)。(6)二硫化钼用作电池的正极材料时接受Li+的嵌入,锂和二硫化钼形成的二次电池的总反应为:xLi+nM
3、oS2Lix(MoS2)n。则电池放电时正极的电极反应是:_。【答案】(1)MoO3+Na2CO3=Na2MoO4+CO2 (2)MoS2+9ClO-+6OH-=MoO42-+9Cl-+2 SO42-+3H2O (3)90% (4)(NH4)2CO3和(NH4)2SO3 (5)常温下浓硫酸会使铁钝化 7.2810-4mol/L (6)nMoS2+xLi+xe-=Lix(MoS2)n 【解析】利用钼精矿(主要成分是M
4、oS2)制备钼酸钠有两种途径:途径是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体。(1)根据题给流程图分析途径I碱浸时,MoO3与碳酸钠溶液反应生成二氧化碳和Na2MoO4,发生反应的化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2;(2)途径氧化时MoS2与次氯酸钠、氢氧化钠溶液反应生成Na2MoO4和硫酸钠,利用化合价升降法结合原子守恒和电荷守恒配平,发生反应的离子方程式为MoS2+9ClO-+6OH-=
5、MoO42-+9Cl-+3H2O;(3)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)= =110-7mol/L,溶液中碳酸根离子的浓度为:c(SO42-)= =110-2mol/L,所以碳酸根离子的去除率为:1=1-10%=90%;故CO32-的去除率是90%;(4)钼酸铵(NH4)2MoO4和氢氧化钠反应生成钼酸钠和氨气,将氨气与途径I所产生的尾气CO2、SO2一起通入水中,得到正盐的化学式是(NH4)2CO3、(NH4)2SO3;(5)浓硫酸具有强氧化性,常温下能使铁钝化。故当硫酸的浓度大于90%时,腐蚀速率几乎为零;根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率
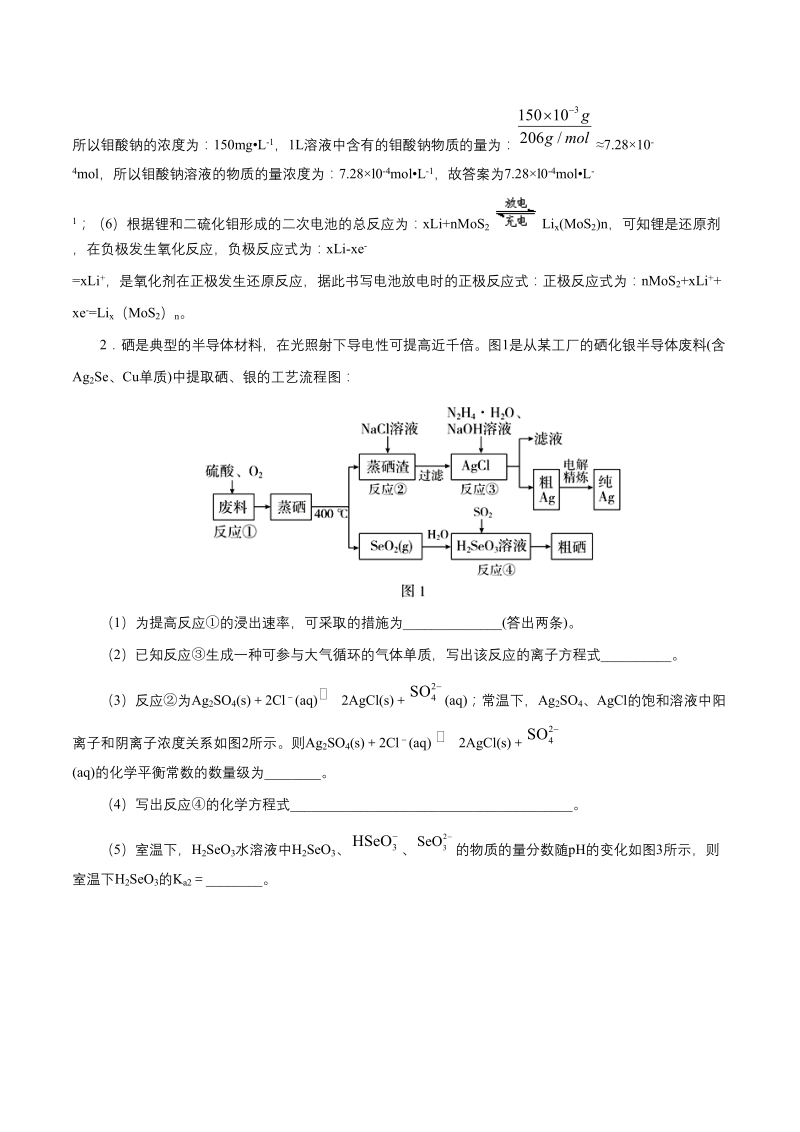
6、最小,缓蚀效果最好,所以钼酸钠的浓度为:150mgL-1,1L溶液中含有的钼酸钠物质的量为:7.2810-4mol,所以钼酸钠溶液的物质的量浓度为:7.28l0-4molL-1,故答案为7.28l0-4molL-1;(6)根据锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2Lix(MoS2)n,可知锂是还原剂,在负极发生氧化反应,负极反应式为:xLi-xe-=xLi+,是氧化剂在正极发生还原反应,据此书写电池放电时的正极反应式:正极反应式为:nMoS2+xLi+xe-=Lix(MoS2)n。2硒是典型的半导体材料,在光照射下导电性可提高近千倍。图1是从某工厂的硒化银半导体废料(含Ag2
7、Se、Cu单质)中提取硒、银的工艺流程图:(1)为提高反应的浸出速率,可采取的措施为_(答出两条)。(2)已知反应生成一种可参与大气循环的气体单质,写出该反应的离子方程式_。(3)反应为Ag2SO4(s)2Cl(aq)2AgCl(s)(aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)2Cl(aq) 2AgCl(s) (aq)的化学平衡常数的数量级为_。(4)写出反应的化学方程式_。(5)室温下,H2SeO3水溶液中H2SeO3、的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2_。【答案】(1)加热、增大硫酸的浓度、粉碎固
8、体废料、搅拌等 (2)4AgClN2H4H2O4OH=4Ag4ClN25H2O (或4AgClN2H44OH=4Ag4ClN24H2O) (3)1014 (4)H2SeO32SO2H2O=2H2SO4Se(或H2SeO32H2SO3=2H2SO4SeH2O) (5)107.3 【解析】(1)根据外界条件对反应速率的影响,为了提高浸出速率,可以采取的措施有加热、增大硫酸的浓度、粉碎固体废料、搅拌等;(2)反应中AgCl转化为Ag,Ag的化合价降低,则N2H4H2O中N
9、的化合价升高,结合题意知N2H4H2O转化为N2,反应的离子方程式为:4AgClN2H4H2O4OH=4Ag4ClN25H2O (或4AgClN2H44OH=4Ag4ClN24H2O);(3)根据题图2,可以计算出Ksp(AgCl)c(Ag)c(Cl)105104.75109.75,Ksp(Ag2SO4)c2(Ag)c(SO)(102)2101105。该反应的平衡常数K 1014.5100.51014,1<100.5<10,故该反应的化学平衡常数的数量级为1014;(4)反应为SO2和H2SeO3的反应,H2SeO3转化为Se,H2SeO3被还原,则SO2被氧化,SO
10、2转化为H2SO4,根据得失电子守恒和原子守恒,配平化学方程式为:H2SeO32SO2H2O=2H2SO4Se;(5)根据题图3,可知pH7.30时,HSeO、SeO的物质的量分数相等,即c(HSeO)c(SeO),则H2SeO3的Ka2 c(H)107.3。3重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿主要成分Fe(CrO2)2(或写成FeOCr2O3),还含有Al2O3、Fe2O3、SiO2等杂质制备,同时还可回收Cr。其主要工业流程如图所示:已知部分物质的溶解度曲线如图1所示。 图1 &
11、nbsp; 图2请回答下列问题:(1)煅烧生成Na2CrO4的化学方程式为_。(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有_(填化学式)。(3)调节溶液的pH所选的试剂为_(填名称)。(4)操作a的实验步骤为 _。(5)加入Na2S溶液反应后,硫元素全部以S2O32的形式存在,写出生成Cr(OH)3的离子方程式_。(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。写出电极b的电极反应方程式:_。测定阳极液中Na元素和Cr元
12、素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为_。(7)根据有关国家标准,含CrO42的废水要经化学处理,使其浓度降至5.0107molL1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀Ksp(BaCrO4)=1.21010,再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应不小于_molL1 ,废水处理后方能达到国家排放标准。【答案】(1)4Fe(CrO2)2+7O2+8 Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2 (2)Na2SiO3、 NaAlO2 (3)
13、稀硫酸 (4)蒸发浓缩、冷却结晶、过滤 (5)23H2O+6S2-+ 8CrO42-= 8Cr(OH)3+ 3S2O32+22OH-。 (6)2H2O-4e-=O2+4H+ (2-n)100; (7)2.4104 【解析】根据铬铁矿的主要成分判断煅烧后的产物,根据杂质的成分及除杂产生的滤渣Al(OH)3和H2SiO3进行逆推,可知浸出液除了含有NaOH、Na2CO3、Na2CrO4外,还含有Na2SiO3, NaAlO2。根据电子守恒完成煅
14、烧反应方程式;根据电池的正负极确定电解池的阴、阳极,根据氧化还原反应写电极反应方程式。(1)铬铁矿主要成分Fe(CrO2)2,还含有Al2O3、Fe2O3、SiO2等杂质, 加入纯碱和空气高温煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+7O2+8Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2;答案:4Fe(CrO2)2+7O2+8 Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2。(2) 根据调节pH后产生滤渣Al(OH)3和H2SiO3.可知加入纯碱和空气高温煅烧后,再加水过滤,浸出液中除了含有NaOH、Na2CO3、Na2CrO4外应该还会有Na2Si
15、O3、NaAlO2。答案:Na2SiO3、NaAlO2。(3)根据酸化产物有Na2SO4可知调节溶液的pH所选的试剂为稀硫酸。答案:稀硫酸。(4)由溶液通过操作a后混合物分离为液体a和固体a两部分,从液体a可以提取重铬酸钠晶体,则固体a为硫酸钠晶体,根据溶解度曲线可知,硫酸钠的溶解度在较高温度下较小,在较低温度下也较小,故可以蒸发浓缩得到硫酸钠的饱和溶液,再降温结晶析出硫酸钠晶体,所以操作a为蒸发浓缩、冷却结晶、过滤;答案:蒸发浓缩、冷却结晶、过滤。(5)加入Na2S溶液反应后,硫元素全部以S2O32的形式存在,CrO42生成Cr(OH)3,的离子方程式:23H2O+6S2-+ 8CrO42-
16、= 8Cr(OH)3+ 3S2O32+22OH-。答案:23H2O+6S2-+ 8CrO42-= 8Cr(OH)3+ 3S2O32+22OH-。(6)根据电池的正负极确定电解池b为阳极,电极反应方式为:2H2O-4e-=O2+4H+;答案:2H2O-4e-=O2+4H+;电解制备Na2Cr2O7过程的总反应方程式为Na2CrO+H2O = Na2Cr2O7+4NaOH+2H2+O2设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x), (1-x)mol,生成的Na2C
17、r2O7为x/2mol,对应的n(Na)=xmol, n(Cr)= xmol,根据: Na与Cr的物质的量之比为n,计算得出x=2-d,转化率为(2-n)/1100=(2-n)100;答案:(2-n)100;(7)国家标准含CrO42的废水要经化学处理,使其浓度降至5.0107molL1,以下才能排放。 Ksp(BaCrO4)=,所以c(Ba2+)= Ksp(BaCrO4)/c(CrO42)= 1.21010/5.0107=2.4104;答案:2.4104。4一种利用化肥中废催化剂(含CoO、Co、Al2O3及少量FeO)制取明矾和CoSO4粗产品的工艺流程如下:已知:(i)相关金属离子形成氢
18、氧化物沉淀的pH范围如下表所示:()Al(OH)3在碱性条件下开始溶解时的pH为7.8,完全溶解时的pH为11。回答下列问题:(1)写出H2O2的电子式:_。(2)下列措施一定能提高步骤I中A13+和Co2+的浸取率的是_(填标号)a将废催化剂粉磨为细颗粒b步骤I中的硫酸采用98%的浓硫酸c适当提高浸取时的温度(3)步骤中,写出“氧化”过程中Fe2+被氧化的离子方程式:_,若“氧化”后再“调节pH=3”,造成的后果是_。(4)步骤中加K2CO3应控制pH的范围为_。(5)测定CoSO4粗产品中钴的质量分数的步骤如下:准确称取ag产品,先经预处理,然后加入过量的冰乙酸,在加热煮沸下,缓慢滴加KN
19、O2溶液直至过量,生成不溶于乙酸的K3Co(NO2)6,再经过滤、洗涤及干燥,称量沉淀的质量为bg。KNO2溶液氧化并沉淀Co2+的离子方程式为_(已知KNO2被还原为NO)。粗产品中钴元素的质量分数为_(MrK3Co(NO2)6=452,列出计算式)。【答案】(1) (2)ac (3)2Fe2+H2O2+4H2O=2Fe(OH)3+4H+ Fe3+对双氧水的分解有催化作用,造成原料利用率低(4)pH11 (5)Co2+3K+7NO2-+2CH3COOHK3Co(NO2)6 +NO+ H2O
20、+2CH3COO- 100% 【解析】废催化剂(含CoO、Co、Al2O3及少量FeO)加入硫酸酸浸反应后得到浸取液,主要含有Co2+、Al3+、Fe2+、H+和SO42-等离子,调节溶液的pH=3,再加入H2O2,Fe2+被氧化为Fe3+并产生Fe(OH)3沉淀。过滤后,滤液中加入K2CO3调节pH,生成Co(OH)2沉淀和KAlO2溶液,经过滤分离。Co(OH)2沉淀加硫酸溶解经后续处理得到粗产品CoSO4,滤液加硫酸酸化得到硫酸铝钾溶液,经结晶得到明矾,以此分析解答。(1)H2O2为共价化合物,两个氧原子共用一对电子,电子式为:,因此,


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2020高考化学大题专项训练含答案解析 2020高考化学大题专项训练含答案解析
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-127321.html