 山东省淄博市淄川2019届高三上学期开学考试化学试卷(含答案)
山东省淄博市淄川2019届高三上学期开学考试化学试卷(含答案)
《山东省淄博市淄川2019届高三上学期开学考试化学试卷(含答案)》由会员分享,可在线阅读,更多相关《山东省淄博市淄川2019届高三上学期开学考试化学试卷(含答案)(8页珍藏版)》请在七七文库上搜索。
1、2019 届高三上学期开学考试化 学 试 题可能用到的相对原子质量: O 16 S 32 Cl 35.5 Na 23 S 32 N 14 I 127第 I 卷(选择题 共 54 分)一、选择题(本题包括 18 小题,每小题 3 分,共 54 分。每小题只有一个选项符合题意)1.下列物质中,属于纯净物的是( )陶瓷 水泥 玻璃 漂白粉 胆矾 氯水 液氯A. B C D2.下列说法正确的是( )A冰水混合物属于化合物,高分子化合物属于混合物B纯碱属于碱、甘油属于油脂CNaHSO 4、NaHCO 3 都属于酸式盐,溶液都呈酸性DSiO 2 既能和 NaOH 溶液反应又能和氢氟酸反应,所以是两性氧化物
2、3阿伏加德罗常数的值为 NA。下列说法正确的是( )A1 L 0.1 molL 1 NH4Cl 溶液中, NH 的数量为 0.1NA 4B2.4 g Mg 与 H2SO4 完全反应,转移的电子数为 0.1NAC标准状况下,2.24 L N 2 和 O2 的混合气体中分子数为 0.2NAD0.1 mol H 2 和 0.1 mol I2 于密闭容器中充分反应后,其分子总数为 0.2NA4关于钠元素的单质及其化合物的叙述不正确的是( )A钠是银白色金属,质软,熔点相对较低,密度比水小BNa 2O2 中阴阳离子个数比为 11C金属钠在空气中长期放置,最终变为碳酸钠DNa 2O 和 Na2O2 都能由
3、金属钠和氧气化合生成,但 Na2O 和 Na2O2 中 O 的价态不同5下列制取 SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )6大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的一项是( )选项 俗名 主要成分(化学式) 用途A 石英 SiO2 集成电路B 纯碱 Na2CO3 制备玻璃C 水玻璃 Na2SiO3 制备硅胶D 铁红 Fe2O3 用作油漆和涂料7已知 16S 和 34Se 位于同一主族,下列关系中正确的是( )A热稳定性:HFHCl H 2SB原子半径:BrSeClC还原性:S 2 Se 2 Cl D酸性:HBr
4、O 4HClO 4 H2SO48.水溶液中能大量共存的一组离子是( )ANa 、Ba 2 、Cl 、SO 24BFe 2 、H 、SO 、ClO 23CK 、Fe 3 、NO 、SCN 3DMg 2 、NH 、Cl 、SO 4 249 下列指定反应的离子方程式正确的是( )A. CuSO4 溶液和氢硫酸反应:Cu 2 S 2 = CuSB. NaAlO2 溶液中通入过量 CO2:AlO 2-+CO2+2H2O=Al(OH)3+HCO3-C. FeSO4 溶液中加入盐酸酸化的 H2O2:Fe 2+H2O2+2H+=Fe3+2H2OD. 稀硫酸与氢氧化钡溶液反应: Ba2 SO =BaSO4241
5、0铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝。下列说法中不正确的是( )铝 土 矿 盐 酸 a 过 量 NaOH溶 液 b c d 电 解 AlA中除加试剂外,还需要进行过滤操作Ba、 b 中铝元素的化合价相同C中需要通入过量的氨气D进行的操作是过滤、加热,而且 d 一定是氧化铝11铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )AFe(OH) 3 Fe2O3 BFe(OH) 2 Fe 2O3CFe(OH) 2 Fe(OH) 3 DFe(OH) 2 FeO1
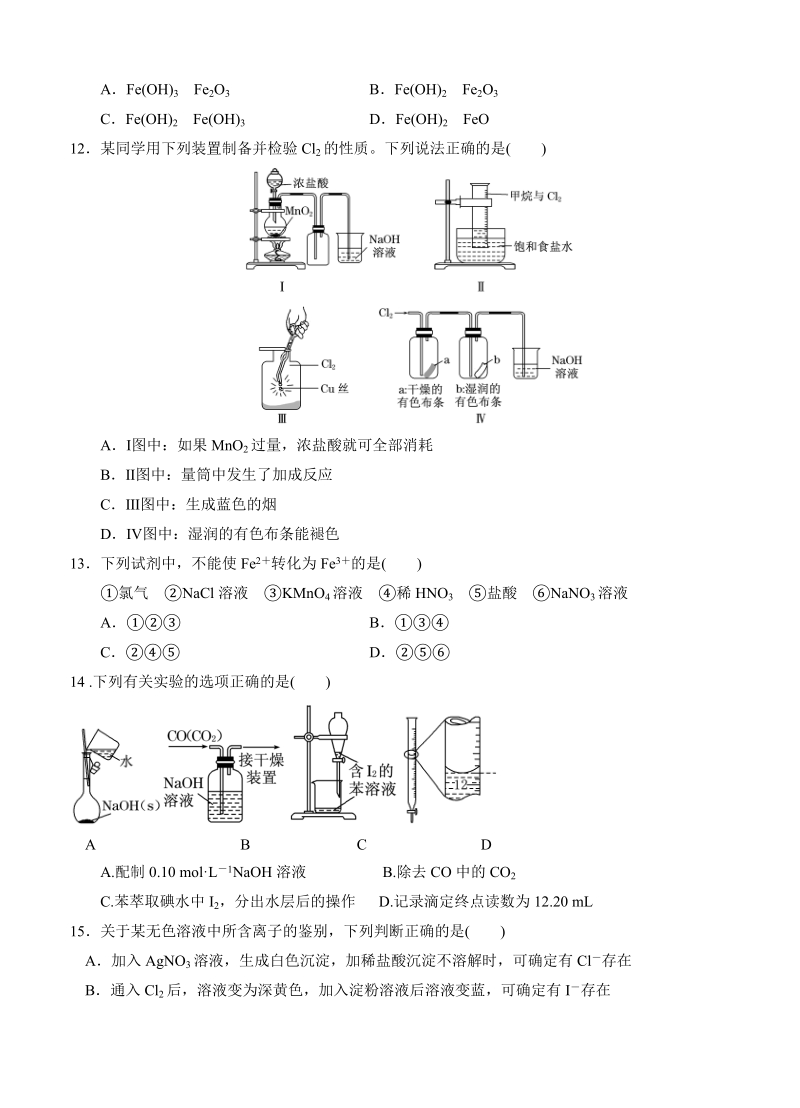
6、2某同学用下列装置制备并检验 Cl2 的性质。下列说法正确的是 ( )A图中:如果 MnO2 过量,浓盐酸就可全部消耗B图中:量筒中发生了加成反应C图中:生成蓝色的烟D图中:湿润的有色布条能褪色13下列试剂中,不能使 Fe2 转化为 Fe3 的是( )氯气 NaCl 溶液 KMnO 4 溶液 稀 HNO3 盐酸 NaNO 3 溶液A BC D14 .下列有关实验的选项正确的是( )A B C DA.配制 0.10 molL1 NaOH 溶液 B.除去 CO 中的 CO2C.苯萃取碘水中 I2,分出水层后的操作 D.记录滴定终点读数为 12.20 mL15关于某无色溶液中所含离子的鉴别,下列判断
7、正确的是( )A加入 AgNO3 溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有 Cl 存在B通入 Cl2 后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有 I 存在C加入 Ba(NO3)2 溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有 SO 存在24D加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有 CO 存在2316下列关于常见有机物的说法中正确的是( )棉花、蚕丝和聚乙烯的主要成分都是纤维素甲烷、乙醇和乙酸在一定条件下都能发生取代反应等质量的乙烷、乙烯、苯充分燃烧,消耗氧气的量由多到少除去乙酸乙酯中残留的乙酸,加过量饱和 Na2CO3 溶液振荡后,静置分液乙酸乙酯和植
8、物油均可水解生成乙醇乙烯、苯、乙醇、油脂都能使酸性 KMnO4 溶液褪色A B C D17.下列化学事实及其解释都正确的是( )A.NO2 与水反应,NO 2 作还原剂,水作氧化剂B.某溶液中含有大量的 NO3-,该溶液中一定不存在大量的 Fe2+C.闪电时,空气中的 N2 和 O2 可直接化合生成 NO2D.除去 NO 中混有少量 NO2 气体时,可以用水洗涤后再干燥18某同学进行 SO2 的性质实验。在点滴板 a、b、c 处分别滴有不同的试剂,再向 Na2SO3 固体上滴加数滴浓 H2SO4 后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。序号 试剂 实验现象aZxxkC


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 山东省 淄博市 淄川 2019 届高三上 学期 开学 考试 化学 试卷 答案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 届高三上
- 淄川数学2020
- 2020淄博市淄川区元旦竞赛数学试卷答案
- 2020淄川
- 2020淄川一模数学
- 2020学年度淄博市淄川区第二学期初三期中考试初中数学
- 2020淄博市淄川区初中数学
- 淄博市淄川区初二地理
- 淄川区数学
- 高三上开学
- 宁夏石嘴山2019届高三上学期开学考试化学试卷含答案
- 山东省夏津2019届高三上学期开学考试数学文试卷含答案
- 山东省夏津2019届高三上学期开学考试数学理试卷含答案
- 山东省淄博市2019届高三三模考试文科综合试卷含答案
- 山东省夏津2019届高三上学期开学考试地理试卷含答案
- 山东省淄博市淄川2019届高三上学期开学考试化学试卷含答案
- 山东省淄博市2019届高三三模考试语文试卷含答案
- 山东省淄博市2019届高三上学期开学考试语文试题含答案
- 山东省夏津2019届高三上学期开学考试英语试卷含答案
- 山东省淄博2019届高三开学考试语文试卷含答案



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-12704.html