 备战2020中考化学知识点归类训练——中和反应
备战2020中考化学知识点归类训练——中和反应
《备战2020中考化学知识点归类训练——中和反应》由会员分享,可在线阅读,更多相关《备战2020中考化学知识点归类训练——中和反应(12页珍藏版)》请在七七文库上搜索。
1、备战2020中考化学知识点归类训练中和反应知识点一:中和反应及其应用1.某些金属氢化物与水反应可生成碱和氢气,如CaH2+2H2OCa(OH)2+2H2,NaH与CaH2的化学性质相似,则将NaH放入足量的稀盐酸中,生成的新物质为()A.NaOH和H2B.NaOH和NaClC.NaOH、H2和NaClD.NaCl和H22.根据图判断以下说法错误的是()A.取液后的滴管不能倒置B.用玻璃棒搅拌使反应充分C.用酚酞溶液判断该反应是否发生D.生成盐和水的反应都是中和反应3.在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸至过量,溶液颜色的变化是()A.红色蓝色B.蓝色红色C.红色无色D.无色红色5.下列
2、物质中,能与稀盐酸发生中和反应的是()A.MgB.MgOC.Mg(OH)2D.MgCO36.中和反应在生活中有广泛应用。下列应用不属于中和反应的是()A.用盐酸除铁锈B.服用含有氢氧化镁的药物治疗胃酸过多C.用熟石灰改良酸性土壤D.用硫酸处理印染厂含碱废水7.在一定量的氢氧化钠稀溶液中逐渐滴加溶质质量分数为0.73%的稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:(1)观察上表发现,当反应时间在_s时,氢氧化钠与盐酸恰好中和。(2)分析上表数据发现,在逐渐滴加稀盐酸的过程中,溶液的温度先升高后降低,请分析原因_。(3)结合上表中滴入稀盐酸体积与pH的变化数据,计
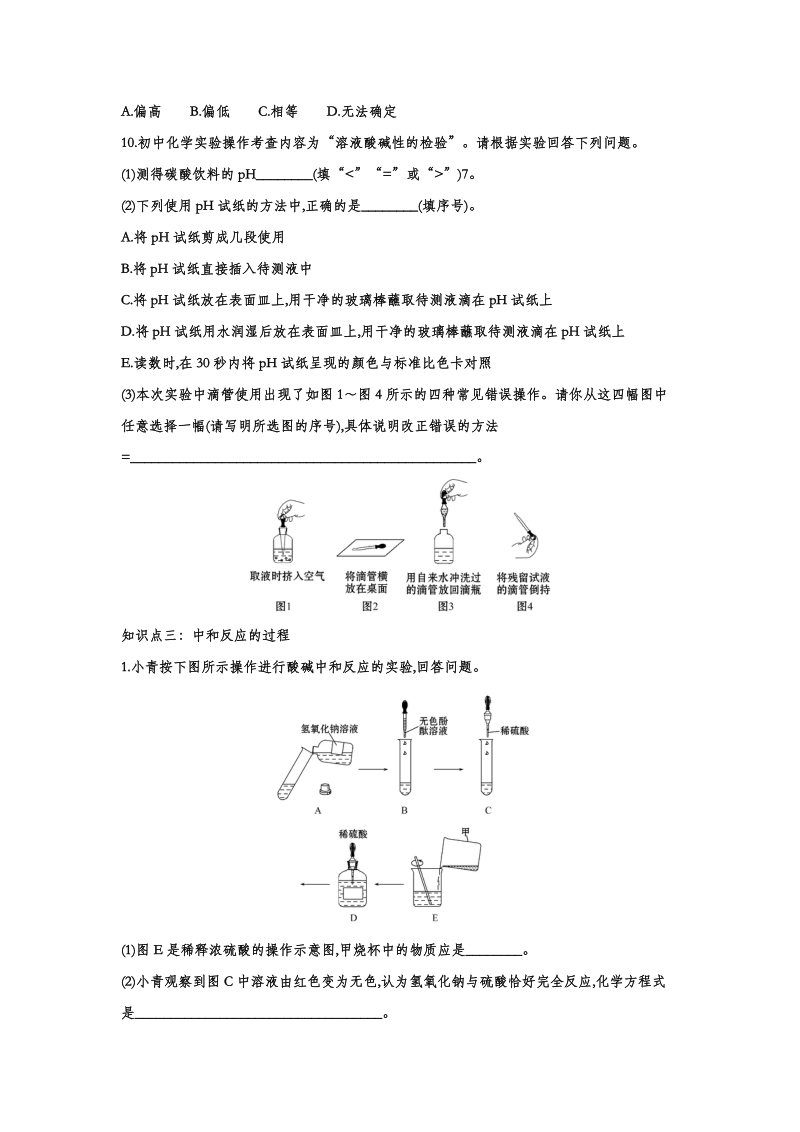
3、算氢氧化钠稀溶液中溶质的质量为多少?(稀盐酸的密度取1.0 gmL-1)8.盐酸、氢氧化钠是常见的酸碱。(1)盐酸溶液中阳离子符号是_,氢氧化钠的俗称是_(写一种)。(2)向稀氢氧化钠溶液中滴入酚酞溶液。当滴入稀盐酸至完全中和时,溶液的颜色变化是_。取少量中和后的溶液加热蒸干,现象是_。(3)根据化学方程式计算,含HCl 7.3 g的稀盐酸可中和氢氧化钠的质量为多少?知识点三:溶液的酸碱性与酸碱度9.用pH试纸测定石灰水的pH,如图所示,则测得的结果与实际值相比()A.偏高B.偏低C.相等D.无法确定10.初中化学实验操作考查内容为“溶液酸碱性的检验”。请根据实验回答下列问题。(1)测得碳酸饮
4、料的pH_(填“”)7。(2)下列使用pH试纸的方法中,正确的是_(填序号)。A.将pH试纸剪成几段使用B.将pH试纸直接插入待测液中C.将pH试纸放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上D.将pH试纸用水润湿后放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上E.读数时,在30秒内将pH试纸呈现的颜色与标准比色卡对照(3)本次实验中滴管使用出现了如图1图4所示的四种常见错误操作。请你从这四幅图中任意选择一幅(请写明所选图的序号),具体说明改正错误的方法=_。知识点三:中和反应的过程1.小青按下图所示操作进行酸碱中和反应的实验,回答问题。(1)图E是稀释浓硫酸的操作示意图,甲烧杯
5、中的物质应是_。(2)小青观察到图C中溶液由红色变为无色,认为氢氧化钠与硫酸恰好完全反应,化学方程式是_。(3)小楚想用紫色石蕊溶液、氧化铜粉末、铜丝进一步确定反应后的无色溶液中是否含有硫酸,其中不能达到目的的是 。2.某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:实验一:取5 mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,此时溶液呈_色,然后逐滴加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为_,微观实质是_,反应后溶液的温度逐渐升高。实验二:对实验一反应后溶液中的溶质进行探究【提出猜想】猜想一:只有NaCl猜想二:有NaCl和NaOH猜想三:有NaCl和HCl你认为
6、猜想_不合理,其理由是_。【设计实验】3.如图表示的是向盛有10 mL稀的甲溶液(其中滴有少量酚酞溶液)中,加入乙溶液后,溶液pH的变化曲线。已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,请分析曲线回答问题:(1)甲是_溶液,该反应的化学方程式为_。(2)当加入乙溶液的体积为_mL时,甲、乙溶液恰好完全反应。(3)当溶液的pH=1.4时,溶液中存在的微观粒子有_(指示剂除外)。(4)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图。请你在右边的圆圈中填入适当的化学用语:知识点一:中和反应及其应用1.某些金属氢化物与水反应可生成碱和氢气,如CaH2+2H2OCa(OH)2+2H2,Na
7、H与CaH2的化学性质相似,则将NaH放入足量的稀盐酸中,生成的新物质为()A.NaOH和H2B.NaOH和NaClC.NaOH、H2和NaClD.NaCl和H2【答案】D。【解析】根据给出的条件,可以看出NaH与水反应生成NaOH和H2,然后氢氧化钠和盐酸中和,生成NaCl和水,故D项正确。2.根据图判断以下说法错误的是()A.取液后的滴管不能倒置B.用玻璃棒搅拌使反应充分C.用酚酞溶液判断该反应是否发生D.生成盐和水的反应都是中和反应【答案】D【解析】取液后的滴管不能倒置,否则会腐蚀胶帽,故A正确;用玻璃棒搅拌可以使反应充分,故B正确;酚酞在碱性溶液中显红色,在酸性、中性溶液中不变色,所以
8、用酚酞溶液判断该反应是否发生,故C正确;酸和碱生成盐和水的反应叫中和反应,但是生成盐和水的反应不一定是中和反应,如二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,不属于中和反应,故D错误。3.在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸至过量,溶液颜色的变化是()A.红色蓝色B.蓝色红色C.红色无色D.无色红色【答案】C。【解析】无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红;氢氧化钠溶液显碱性,能使酚酞溶液变红色;逐滴加入稀盐酸至过量,氢氧化钠与盐酸反应生成氯化钠和水,恰好完全反应时溶液显中性,溶液由红色变为无色;至稀盐酸过量,溶液显酸性,溶液仍显无色,故溶液颜色的变化是红色无色。5.下列物质中,能
9、与稀盐酸发生中和反应的是()A.MgB.MgOC.Mg(OH)2D.MgCO3【答案】C。【解析】碱和稀盐酸能发生中和反应,题中四种物质中只有Mg(OH)2属于碱。6.中和反应在生活中有广泛应用。下列应用不属于中和反应的是()A.用盐酸除铁锈B.服用含有氢氧化镁的药物治疗胃酸过多C.用熟石灰改良酸性土壤D.用硫酸处理印染厂含碱废水【答案】A。【解析】中和反应是酸与碱之间生成盐和水的反应,反应物必须是酸和碱,生成物必须是盐和水。用稀盐酸除铁锈是铁锈的主要成分氧化铁与盐酸反应生成氯化铁和水,属于金属氧化物与酸反应,不属于中和反应,故A符合题意。7.在一定量的氢氧化钠稀溶液中逐渐滴加溶质质量分数为0


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 备战 2020 中考 化学 知识点 归类 训练 中和 反应
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-125380.html