 2017版高考化学苏教版(浙江专用)一轮复习文档:专题6 第一单元化学反应中的热效应 Word版含答案
2017版高考化学苏教版(浙江专用)一轮复习文档:专题6 第一单元化学反应中的热效应 Word版含答案
《2017版高考化学苏教版(浙江专用)一轮复习文档:专题6 第一单元化学反应中的热效应 Word版含答案》由会员分享,可在线阅读,更多相关《2017版高考化学苏教版(浙江专用)一轮复习文档:专题6 第一单元化学反应中的热效应 Word版含答案(29页珍藏版)》请在七七文库上搜索。
1、考试标准知识条目必考要求加试要求1.化学反应中能量转化的主要形式ab2.吸热反应和放热反应aa3.从化学反应中的反应物的总能量与生成物的总能量变化理解反应中的热效应bb4.化学键的断裂和形成与反应中能量变化的关系bc5.利用热化学方程式进行简单计算bc6.合理利用化石燃料,提高燃料燃烧效率的方法aa7.反应热a8.焓变的含义a9.焓变与键能的关系c10.中和热的测定b11.标准燃烧热的概念、热值的概念a12.盖斯定律及其简单计算b13.太阳能开发利用的途径和方式aa14.生物质能的利用途径aa15.氢能的优点、开发与利用aa16.了解化石燃料的不可再生性及给环境带来的问题aa考点一化学反应中的
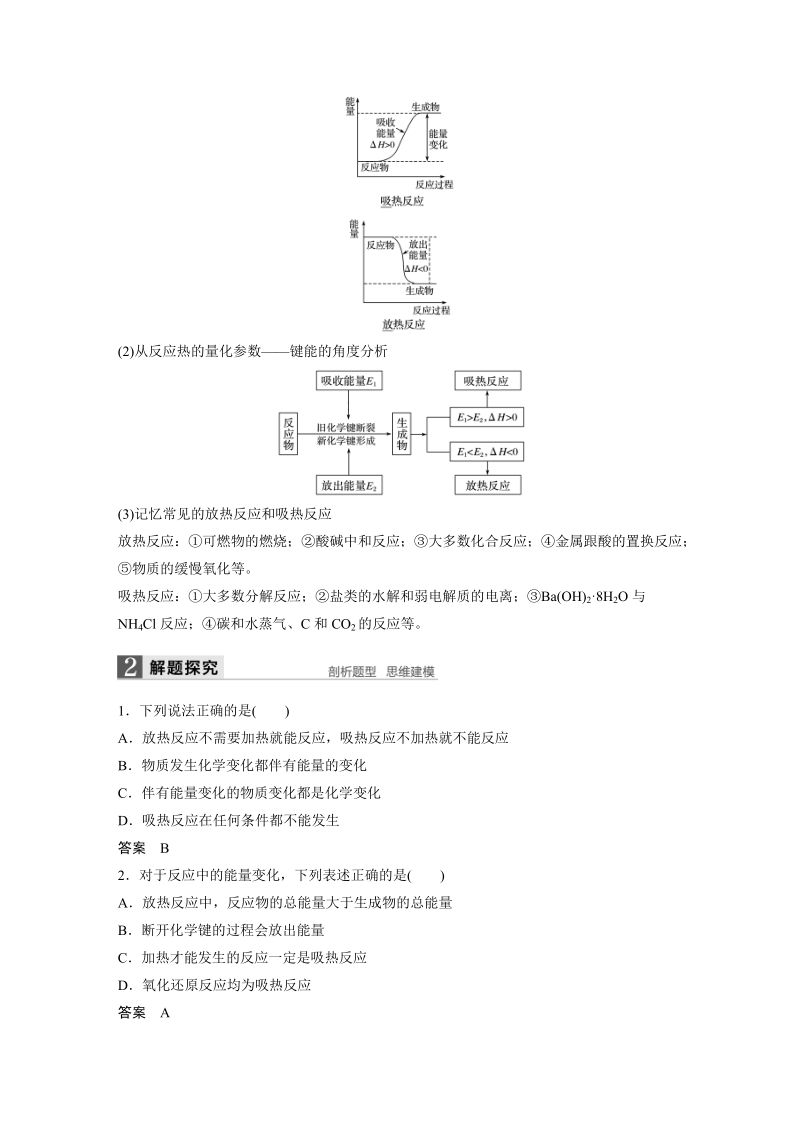
2、热量1化学反应中能量转化的主要形式化学反应都伴随着能量变化,有的吸收能量,有的放出能量。化学反应中的能量变化有多种形式,通常表现为热能、光能、电能等,但主要表现为热量变化。化学上把有热量放出的化学反应称为放热反应,把吸收热量的化学反应称为吸热反应。2从两个角度理解放热反应和吸热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。(2)从反应热的量化参数键能的角度分析(3)记忆常见的放热反应和吸热反应放热反应:可燃物的燃烧;酸碱中和反应;大多数化合反应;金属跟酸的置换反应;物质的缓慢氧化等。吸热反应:大多数分解反应;盐类的水解和弱电解质的电离;Ba(OH)28H2O与NH4Cl反应;
3、碳和水蒸气、C和CO2的反应等。1下列说法正确的是()A放热反应不需要加热就能反应,吸热反应不加热就不能反应B物质发生化学变化都伴有能量的变化C伴有能量变化的物质变化都是化学变化D吸热反应在任何条件都不能发生答案B2对于反应中的能量变化,下列表述正确的是()A放热反应中,反应物的总能量大于生成物的总能量B断开化学键的过程会放出能量C加热才能发生的反应一定是吸热反应D氧化还原反应均为吸热反应答案A解析反应物的总能量大于生成物的总能量,反应放热,A项正确;断开化学键需要吸收能量,B项错误;很多放热反应也需要加热,如铝热反应是放热反应,它需要加热到高温,反应才能发生,故C项错误;氧化还原反应中,有的
4、是吸热的,有的是放热的,例如,加热高锰酸钾制取氧气的反应是吸热反应,氢气燃烧的反应是放热反应,D项错误。3下列反应中,属于吸热反应的是()A食物的腐败B铝与稀盐酸反应C二氧化碳与碳反应生成一氧化碳D甲烷在氧气中的燃烧答案C解析食物的腐败、铝与稀盐酸反应、甲烷在氧气中的燃烧均属于放热反应,故A、B、D均错误;二氧化碳与碳反应生成一氧化碳属于吸热反应,故C项正确。4已知反应XY=MN为放热反应,对该反应的下列说法中正确的是()AX的能量一定高于M和N的能量BX和Y的总能量一定高于 M和N的总能量CY的能量一定高于N的能量D由于该反应为放热反应,故不必加热就可发生答案B解析XY=MN为放热反应,说明
5、反应物的总能量一定高于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,B项正确,A、C均错误;有些放热反应需加热后才能发生,如铝热反应,D项错误。5物质发生化学反应时总是伴随能量的变化。下列化学反应中,反应物的总能量低于生成物的总能量的是()A石灰石高温分解B硫粉和铁粉混合物加热C钠和水反应D铝粉和氧化铁混合粉末引燃答案A解析反应物的总能量低于生成物的总能量说明反应是吸热的。石灰石高温分解是吸热反应;硫粉和铁粉混合物加热是放热反应;钠和水反应是放热反应;铝粉和氧化铁混合粉末引燃是放热反应。故A项符合题意。6下列关于反应能量的说法中正确的是()A化学反应中的能量变化,都表现为热量的变化B
6、化学键的断裂和形成是化学反应中能量变化的主要原因C已知反应:Zn(s)CuSO4(aq)=ZnSO4(aq)Cu(s)为放热反应,则反应物总能量生成物总能量D相同条件下,如果1 mol 氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1E2答案B考点二热化学方程式1概念表示参加反应物质的量和反应热的关系的化学方程式。2意义表明了化学反应中的物质变化和能量变化。如:2H2(g)O2(g)=2H2O(l)H571.6 kJmol1表示:2 mol氢气和1 mol氧气反应生成2 mol液态水时放出571.6 kJ的热量。3书写(1)注明反应条件:反应热与测定条件(温度、压强等)有关。
7、绝大多数反应是在25 、101 kPa下进行的,可不注明。(2)注明物质状态:常用s、l、g、aq分别表示固体、液体、气体、溶液。(3)注意符号单位:H应包括“”或“”(“”可省略)、数字和单位(kJmol1)。(4)注意守恒关系:原子守恒和得失电子守恒;能量守恒。(H与化学计量数相对应)(5)区别于普通方程式:一般不标注“”、“”以及“点燃”、“加热”等。(6)注意热化学方程式的化学计量数热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。且化学计量数必须与H相对应,如果化学计量数加倍,则H也要加倍。题组一多角度书写热化学方程式角度一依据反应事实书写热
8、化学方程式1依据事实,写出下列反应的热化学方程式。(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为_。(2)在25 、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为_。答案(1)SiH4(g)2O2(g)=SiO2(s)2H2O(l)H1 427.2 kJmol1(2)C2H5OH(l)3O2(g)=2CO2(g)3H2O(l)H2Q kJmol1解析(1)2 g S
9、iH4自燃放出热量89.2 kJ,1 mol SiH4自燃放出热量1 427.2 kJ,故热化学方程式为SiH4(g)2O2(g)=SiO2(s)2H2O(l)H1 427.2 kJmol1。(2)根据C原子守恒有:C2H5OH2CO22CaCO3。生成100 g CaCO3沉淀,则乙醇为0.5 mol,据此可写出反应的热化学方程式。角度二依据能量图像书写热化学方程式2已知化学反应A2(g)B2(g)=2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:_。答案A2(g)B2(g)=2AB(g)H(ab) kJmol1解析由图可知,生成物的总能量高于反应物的总能量,故该反应为吸热反应,
10、H(ab) kJmol1。题组二“五”看,快速判断热化学方程式的正误3已知充分燃烧a g 乙炔气体时生成1 mol 二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()A2C2H2(g)5O2(g)=4CO2(g)2H2O(l)H4b kJmol1BC2H2(g)O2(g)=2CO2(g)H2O(l)H2b kJmol1C2C2H2(g)5O2(g)=4CO2(g)2H2O(l)H2b kJmol1D2C2H2(g)5O2(g)=4CO2(g)2H2O(l)Hb kJmol1答案A解析由题给条件可知,生成1 mol CO2气体和液态水放出热量b kJ,所以生成4 mo
11、l CO2气体和液态水放出热量4b kJ,A项正确。4实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是()CH4(g)2O2(g)=CO2(g)2H2O(l)H890.3 kJmol1CH4(g)2O2(g)=CO2(g)2H2O(l)H890.3 kJmol1CH4(g)2O2(g)=CO2(g)2H2O(g)H890.3 kJmol12H2(g)O2(g)=2H2O(l)H571.6 kJmol1A仅有 B仅有C仅有 D全部符合要求答案B解析书
12、写热化学方程式时要重点注意其与普通化学方程式不同的几点:(1)生成物的稳定状态,H2O为液态,C的稳定化合物为CO2;(2)单位是kJmol1,不是kJ;(3)数值,H的数值要与方程式中化学计量数保持一致;(4)符号,吸热用“”(“”可省略),放热用“”。仅符合要求。做到“五看”,快速判断1看方程式是否配平。2看各物质的聚集状态是否正确。3看H的符号是否正确。4看反应热的单位是否为kJmol1。5看反应热的数值与化学计量数是否对应。考点三能源1能源分类2解决能源问题的措施(1)提高能源的利用效率:改善开采、运输、加工等各个环节;科学控制燃烧反应,使燃料充分燃烧。(2)开发新能源:开发资源丰富、
13、可以再生、没有污染或污染很小的新能源。1下列说法不正确的是()A太阳能是清洁能源B化石燃料和植物燃料燃烧时放出的能量均来源于太阳能C农村用沼气池产生的沼气作燃料属于生物质能的利用D人类利用的能源都是通过化学反应获得的答案D2下列说法不正确的()A食用植物体内的淀粉、蛋白质等属于直接利用能源B开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量C开发太阳能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料D低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放答案A3下列措施可以提高燃料燃烧效率的是()提高燃料的着火点降低燃料的着火点将固体燃料粉碎将液体燃料雾
14、化处理将煤进行气化处理通入适当过量的空气A BC D答案C4将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是()使煤充分燃烧,提高煤的利用率减少SO2的产生,避免造成“酸雨”减少有毒的CO产生,避免污染空气减少CO2的产生,避免“温室效应”A BC D答案A5为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是()AH2O的分解反应是放热反应B氢能源已被普遍使用C2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量D氢气不易贮存和运输,无开发利用价值答案C解析2H2O(l)=2H2(g)O2(g
15、)是吸热反应,说明2 mol 液态H2O的能量低于2 mol H2和1 mol O2的能量。因由水制取H2耗能多且H2不易贮存和运输,所以氢能源利用并未普及,但发展前景广阔。考点四焓变与反应热(加试)1焓变、反应热(1)定义:在恒温、恒压条件下进行的反应的热效应。(2)符号:H。(3)单位:kJmol1或kJ/mol。2焓变与键能的关系(1)键能键能是指气态基态原子形成1_mol_化学键释放的最低能量。(2)H反应物总键能之和生成物总键能之和。题组一正确理解概念1下列说法正确的是()ANa转化为Na时,吸收的能量就是该过程的反应热B水蒸气变为液态水时,放出的能量就是该变化的反应热C同温同压下,
16、反应H2(g)Cl2(g)=2HCl(g)在光照和点燃条件下的H不同D可逆反应的H表示完全反应时的热量变化,与反应是否可逆无关答案D2H2和I2在一定条件下能发生反应:H2(g)I2(g)2HI(g)Ha kJmol1已知:(a、b、c均大于零)下列说法不正确的是()A反应物的总能量高于生成物的总能量B断开1 mol HH键和1 mol II键所需能量大于断开2 mol HI键所需能量C断开2 mol HI键所需能量约为(cba)kJD向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ答案B解析A项,反应放热,说明反应物的总能量高于生成物的总能量,正确;B项
17、,由题意可知,该反应放热,则断开1 mol HH键和1 mol II键所吸收能量小于形成2 mol HI键所放出的能量,即断开1 mol HH键和1 mol II键所需能量小于断开2 mol HI键所需能量,错误;C项,由题意可知,HH键的键能E(HH)b kJmol1,II键的键能E(II)c kJmol1,而HE(HH)E(II)2E(HI),则2E(HI)E(HH)E(II)Hbc(a)kJmol1(bca)kJmol1,故断开2 mol HI键所需能量约为(cba)kJ,正确;D项,由于该反应是可逆反应,反应不能进行到底,故向密闭容器中加入2 mol H2和2 mol I2,充分反应后
18、生成HI的物质的量小于4 mol,故放出的热量小于2a kJ,正确。题组二依据共价键数,利用键能计算反应热3(2015北京四中模拟)已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:O=OHHHO(g)1 mol化学键断裂时需要吸收的能量/kJ496436x则表中x为()A920 B557C463 D188答案C解析根据题意,可得热化学方程式为2H2(g)O2(g)=2H2O(l)H572 kJmol1;而18 g水蒸气变成液态水时放出44 kJ热量,则2H2(g)O2(g)=2H2O(g)H484 kJmol1,即484
19、 kJ2436 kJ496 kJ4x kJ,解得x463。4化学反应的H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用。化学键SiOSiClHHHClSiSiSiC键能/kJmol1460360436431176347工业上的高纯硅可通过下列反应制取:SiCl4(g)2H2(g)=Si(s)4HCl(g),该反应的反应热H为_。答案236 kJmol1解析SiCl4、H2和HCl分子中共价键的数目容易计算,而产物硅属于原子晶体,可根据原子晶体的结构计算晶体硅中的共价键的数目。1 mol晶体硅中所含的SiSi键为 2 mol,即制取


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 2017版高考化学苏教版浙江专用一轮复习文档:专题6 第一单元化学反应中的热效应 Word版含答案 2017 高考 化学 苏教版 浙江 专用 一轮 复习 文档 专题 第一 单元 化学反应 中的 热效应
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
文档标签
- 2017版高考化学苏教版浙江专用一轮复习文档:专题10
- Word版含答案
- 化学反应
- 2017版高考化学苏教版浙江专用一轮复习文档专题8
- 2017版高考化学苏教版浙江专用一轮复习文档专题5
- 2017版高考化学苏教版浙江专用一轮复习文档专题12
- 2017版高考化学苏教版浙江专用一轮复习文档专题6
- 2017版高考化学苏教版浙江专用一轮复习文档专题11
- 2017版高考化学苏教版浙江专用一轮复习文档专题4
- 2017版高考化学苏教版浙江专用一轮复习文档专题1
- 2017版高考化学苏教版浙江专用一轮复习文档专题10
- 2017版高考化学苏教版浙江专用一轮复习文档专题7
- 2017版高考化学苏教版浙江专用一轮复习文档专题9
- 2017版高考化学苏教版浙江专用一轮复习文档专题2



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-104509.html