 人教版高中化学必修一教案-2.1 物质的分类 《分散系及其分类》
人教版高中化学必修一教案-2.1 物质的分类 《分散系及其分类》
《人教版高中化学必修一教案-2.1 物质的分类 《分散系及其分类》》由会员分享,可在线阅读,更多相关《人教版高中化学必修一教案-2.1 物质的分类 《分散系及其分类》(8页珍藏版)》请在七七文库上搜索。
1、第一节 物质的分类第2课时 分散系及其分类学习目标:1.知道分散系的概念和分类,了解胶体是一种分散系,学习胶体的相关性质;2.通过实验演示,能区分溶液、胶体、浊液,知道其本质区别,了解丁达尔效应;3.通过对胶体的本质特征和性质的探究,体验科学探究的艰辛与喜悦,感受化学世界的奇妙与和谐。学习重点: 胶体的性质与制备,以及溶液、胶体、浊液的本质区别。学习难点:胶体的制备与性质。教学过程:一、 导入新课引入 上节课我们学习了分类方法,并且简单了解了分散系的相关知识,那么我们最学见的分散系溶液、胶体、浊液又是按什么分的呢?分散质离子的直径大小。溶液:分散质直径100纳米讲解如果将溶液、胶体、浊液这三类
2、物质长期存放,我们会发现溶液是最稳定的。不论存放的时间有多长,在一般情况下溶质都不会自动与溶剂分离;而浊液很不稳定,分散质将在重力的作用下沉降下来,如河水中夹带泥沙会逐渐沉降;胶体则介于二者之间,在一定条件下能稳定存在,属于介稳体系。过渡生活中,我们将淀粉溶解在热水中,然后加热煮沸,就熬成了汤,可以较长时间稳定地存在;而向豆浆里加入石膏,就变成了豆腐,是什么原因呢?黄河里的水奔腾不息,为什么泥水就不变清呢?在灯光下,有雾的夜晚,为何显得更加明亮。今天我们重点先来研究胶体的性质。板书 分散系及其分类二、 推进新课教学环节一:胶体板书一、胶体1.胶体的分类 投影(1)根据分散质微粒组成的状况分类:
3、粒子胶体分子胶体讲解如:Fe(OH)3胶体胶粒是由许多Fe(OH)3等小分子聚集一起形成的微粒,其直径在1nm100nm之间,这样的胶体叫粒子胶体。 又如:淀粉属高分子化合物,其单个分子的直径在1nm100nm范围之内,这样的胶体叫分子胶体。 投影 (2)根据分散剂的状态划分:气溶胶液溶胶固溶胶讲解如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、Fe(OH)3溶胶、Al(OH)3溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。 板书2.胶体的制备实验探究:胶体的制备步骤:1、取烧杯盛25 mL蒸馏水(不用自来水,是因为
4、自来水中有电解质,会使胶体聚沉),加热至沸腾;2、向沸水中逐滴加入5-6滴FeCl3饱和溶液(一般不用稀溶液,因稀溶液水解程度大,可能会浑浊,且滴加速度不能过快,更不能将FeCl3溶液加到蒸馏水中以后再煮沸,否则会生成沉淀)3、继续煮沸至溶液呈红褐色,观察所得红褐色液体是Fe(OH)3 胶体。提问胶体和溶液的外观特征相同(透明澄清),如NaCl溶液和淀粉溶液,那么可用怎样的物理方法加以鉴别呢?学生活动一代表上台演示。操作:将分别盛有等量硫酸铜溶液和Fe(OH)3胶体的两烧杯并排置于桌面上,用激光教鞭从一侧(光、两烧杯在一条线上)进行照射,同时于垂直方向观察。现象与结论:当光束通过形成一条光亮红
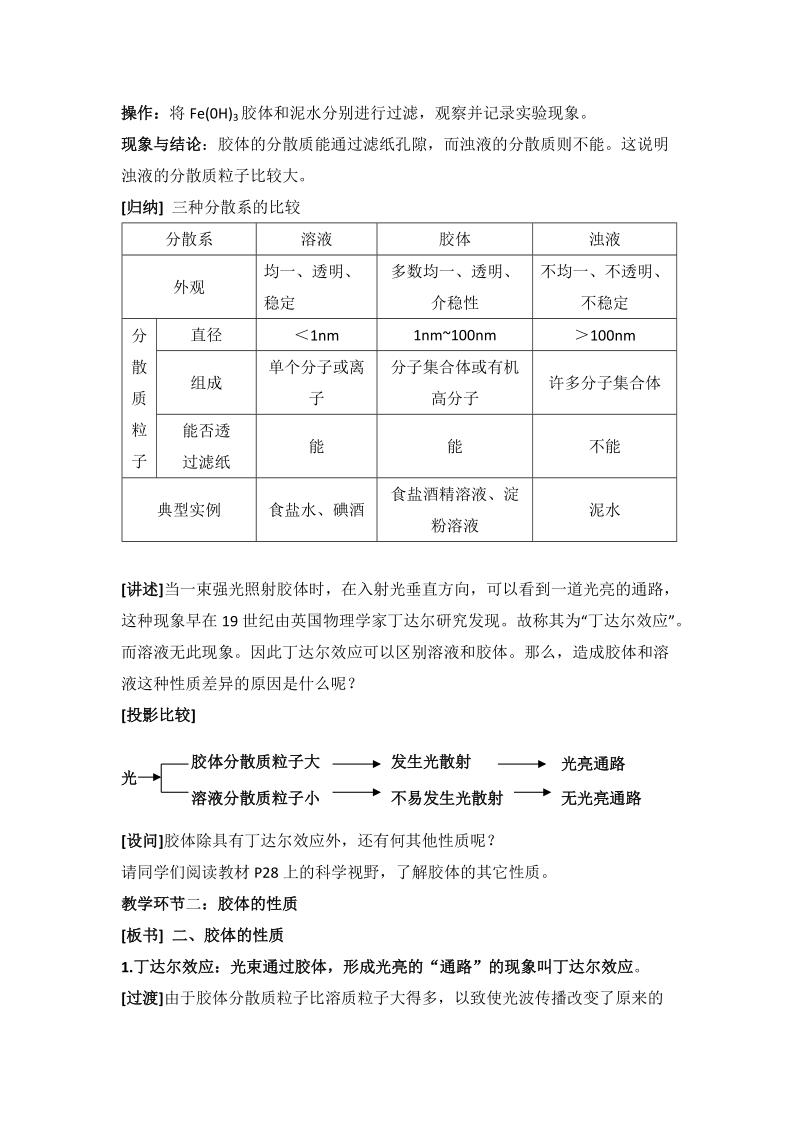
5、色通路的液体为Fe(OH)3胶体,无此现象的为硫酸铜溶液。操作:将Fe(0H)3胶体和泥水分别进行过滤,观察并记录实验现象。现象与结论:胶体的分散质能通过滤纸孔隙,而浊液的分散质则不能。这说明浊液的分散质粒子比较大。归纳 三种分散系的比较分散系溶液胶体浊液外观均一、透明、稳定多数均一、透明、介稳性不均一、不透明、不稳定分散质粒子直径1nm1nm100nm100nm组成单个分子或离子分子集合体或有机高分子许多分子集合体能否透过滤纸能能不能典型实例食盐水、碘酒食盐酒精溶液、淀粉溶液泥水讲述当一束强光照射胶体时,在入射光垂直方向,可以看到一道光亮的通路,这种现象早在19世纪由英国物理学家丁达尔研究发
6、现。故称其为“丁达尔效应”。而溶液无此现象。因此丁达尔效应可以区别溶液和胶体。那么,造成胶体和溶液这种性质差异的原因是什么呢?投影比较胶体分散质粒子大光亮通路发生光散射 无光亮通路溶液分散质粒子小不易发生光散射光 设问胶体除具有丁达尔效应外,还有何其他性质呢?请同学们阅读教材P28上的科学视野,了解胶体的其它性质。教学环节二:胶体的性质板书 二、胶体的性质1.丁达尔效应:光束通过胶体,形成光亮的“通路”的现象叫丁达尔效应。过渡由于胶体分散质粒子比溶质粒子大得多,以致使光波传播改变了原来的方向。尽管如此,我们的肉眼仍看不到它的存在。超显微镜可帮助我们了解胶粒的情况。多媒体动画模拟胶粒的布朗运动。


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 人教版 高中化学 必修 教案
 七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
七七文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 浙公网安备33030202001339号
浙公网安备33030202001339号
链接地址:https://www.77wenku.com/p-104348.html